發布日期:2024-7-10 18:13:22
生物材料因其良好的綜合力學性能及優異的生物相容性,現已廣泛應用于骨科、口腔科、皮膚組織工程、心血管等領域[1],在疾病的診斷治療、創傷的替換修復或誘導再生等方面應用廣泛[2]。生物材料在骨科疾病治療中發揮重要作用,常見植入物材料包括生物陶瓷、不銹鋼、鈦、鎂、鈷合金、醫用超高分子量聚乙烯材料等。
鈦是一種重要的金屬元素,密度為4.51g/cm3,接近人體硬組織,且其生物相容性、耐腐蝕性和抗疲勞性能優于不銹鋼材料、鈷合金材料等。鈦合金是目前最佳的金屬醫用材料之一,在骨科領域有廣泛應用。
然而,作為骨科常用植入物材料,鈦及鈦合金依然存在許多不足,比如:“應力遮擋”效應[3],強度較低、表面耐磨性能較差,Ti-6Al-4V等傳統鈦合金中所含的鋁、釩等元素對機體存在潛在危害[4]等,因此,仍需要開發高性能的生物醫用鈦合金來滿足臨床應用需求。本文從鈦及鈦合金力學性能、耐腐蝕耐磨性能、成骨性能、抗菌性能等方面闡述鈦及鈦合金最新研究進展,并對未來生物醫用鈦合金研究方向進行展望。
1、微觀結構特點及發展階段
自20世紀以來,金屬植入物已在醫學領域廣泛應用。作為體內臨時或永久植入物,金屬材料成為骨科手術中不可分割的組成部分。金屬材料與其他非金屬材料相比,具有許多優點:高拉伸強度、高韌性,較好的耐沖擊性、延展性及成型加工性能,性能穩定等。因此,將金屬材料作為植入物材料的趨勢不會改變。
鈦作為一種雙相的同素異形體,在室溫時,以密排六方(HCP)結構形式存在,稱為α型;在883℃時,轉變為β型體心立方(BCC)結構。鈦合金的平衡和亞穩定狀態分為5種合金類別:近α、α、α+β、近β和β。
醫用鈦及鈦合金發展可分為3個階段:初始階段以純鈦和Ti-6Al-4V合金為代表。純鈦具有α型結構,20世紀40年代,研究人員發現純鈦植入老鼠股骨后未引起不良反應,后進一步證實純鈦具有良好生物相容性。20世紀60年代,純鈦作為口腔植入物應用于臨床,后作為外科植入物材料不斷發展。但由于純鈦強度較低,耐磨損性能差,影響了其在較大承載力部位的應用。Ti-6Al-4V合金組織類型是α+β型,起初應用于航空航天領域,在20世紀70年代被制成接骨板、髓內釘、關節置換物等材料用于外科創傷修復或關節替換。Ti-6Al-4V合金較純鈦強度更高,同時具有良好的加工性能,被廣泛用于生物醫用領域。但是,Ti-6Al-4V合金材料中所含的鋁、釩元素被認為對生物具有危害性。研究顯示,釩化物可影響各種三磷酸腺苷酶、蛋白激酶、核糖核酸酶和磷酸酯酶活性[5],鋁元素可導致骨軟化病或引起貧血、神經紊亂等癥狀[6],同時以鋁鹽形式造成器官損傷。植入鈦合金發展的第2階段以Ti-6Al-7Nb和Ti-5Al-2.5Fe為代表,組織類型為新型α+β型合金。這類新型合金以鐵、鈮元素取代了有毒性的釩元素,彈性模量與純鈦和Ti-6Al-4V相近,強度也有所提高。1985年瑞士Sulzar公司利用Ti-6Al-7Nb合金制造了髖關節假體股骨柄,在臨床得以應用。而Ti-5Al-2.5Fe合金因冶金質量、加工性能欠佳等問題而在應用方面受到局限。第3階段為不含鋁、釩元素的低彈性模量新型β型鈦合金材料,包括以Ti-13Nb-13Zr,Ti-12Mo-6Zr-2Fe和Ti-15Mo為代表的β型或近β型鈦合金。它們具有強度高、生物相容性好、彈性模量更接近人體骨骼等優點。1994年,美國研制的Ti-13Nb-13Zr合金是最早被正式列入國際標準的近β型醫用鈦合金,隨后又研制出亞穩態β型Ti-12Mo-6Zr-2Fe合金,在2000年被Strker公司用作制備髖關節假體的股骨柄,并在臨床中應用。除此之外,有多種新型β型鈦合金材料用作制備人工牙齒根、螺釘、接骨板、植入棒等植入材料。目前臨床仍以純鈦和Ti-6Al-4V合金為主流應用材料,但新型β型鈦合金因具有更低的彈性模量和更好的生物相容性成為研究的熱點,是最有應用前景的生物醫用鈦合金。
2、力學性能特點
鈦合金作為常用的骨科植入物材料,與不銹鋼材料和鈷合金材料相比,彈性模量有所降低,但和骨骼相比仍較高。植入體內后仍存在“應力遮擋”效應,會引起骨密度降低并增加植入物植入失敗風險。為滿足骨科領域對植入物材料低彈性模量需求,研究人員進行大量研發工作,制備了具有優異綜合性能的鈦合金材料。
2.1低彈性模量鈦合金
合金化處理是改善醫用鈦合金力學性能的主要方法,選擇添加元素需要遵守的原則有:元素無毒性、不致敏性并且可改善合金的力學性能。近年來所研發的新型β鈦合金主要有Ti-Nb系合金、Ti-Mo系合金、Ti-Zr系合金和Ti-Ta系合金。與其他體系β鈦合金相比,這些體系的β鈦合金彈性模量更低,更接近于人骨的彈性模量。它們用生物相容性好,無毒的Nb,Mo,Zr,Ta等元素取代了Al和V,更適合作為骨科植入物材料。已研制成功的部分醫用鈦合金有:Ti-13Nb-13Zr,Ti-20Nb-0.5Ru,Ti-20Nb-1.0Ru,Ti-24Nb-4Zr-8Sn,Ti-25Nb,Ti-25Nb-1Sn-2Cr,Ti-29Nb-2Mo-6Zr,Ti-30Nb-32Zr,Ti-32Nb-2Sn,Ti-35Nb-7Zr-5Ta,Ti-35Nb-2Ta-3Zr,Ti-7Mo,Ti-15Zr-15Mo,Ti-15Zr-20Mo,Ti-20Zr-10Mo,Ti-10Fe-10Ta等。合金材料制備工藝及力學性能見表1 [7-21]。
長期以來,Ti-Nb系合金由于高生物相容性、低彈性模量等特點使其作為骨科植入物候選材料而引起關注。Nb作為合金元素加入,可使Ti-Nb合金彈性模量降低。基于Ti-Nb系統,通過添加不同含量及不同種類的β相穩定元素,研制出三元、四元Ti-Nb合金。它們具有不同的彈性模量、抗拉強度等力學性能。雖然研究人員對Mo元素的生物相容性存在擔憂[22],但是Mo元素作為β相穩定劑,可制備出具有高拉伸強度和較低彈性模量的Ti-Mo合金。除此之外,添加了無毒元素Fe和Ta的Ti-10Fe-10Ta合金,由于Ta元素的添加,合金材料同樣顯示出較低的彈性模量。
2.2多孔鈦合金
制備具有優異綜合力學性能的鈦合金材料,除加入不同合金化元素外,還可通過制備多孔結構來達到這一目的。常用的制備多孔材料方法包括:發泡法、粉末冶金法、纖維燒結法、等離子噴涂法、凝膠注模成型法、激光打孔技術[23]、3D打印技術[24]等。制備多孔鈦合金材料時,應在降低鈦合金材料彈性模量同時保證其具有適宜的強度。目前,研究者研發出如Ti-6Al-4V多孔合金、Ti-3Cu多孔合金、Ti-Ag/Ti徑向梯度多孔復合材料、Ti-2Cu-4Ca多孔合金、Ti-35Zr-28Nb多孔合金等,不難看出,此類材料顯示出比合金化處理更低的彈性模量,見表2[25-32]。
除此之外,Guo等[33]通過放電等離子體燒結技術,將Ti和磷酸三鈣(α-TCP)混合粉末覆蓋在Ti網孔上,制備了Ti/α-TCP/Ti網狀復合材料,實驗結果顯示Ti含量為70%(質量分數,下同)的Ti/α-TCP具有最佳的力學性能,70Ti/α-TCP/Ti網狀復合材料的彈性模量為30GPa,抗壓強度為589MPa。α-TCP作為一種促進新骨形成的添加劑,顯示出良好的生物活性及生物相容性,使該復合材料作為植入物材料方面具有良好潛在應用價值。
臨床中采用的固定骨折部位的接骨板常具有較高的彈性模量和較高強度,鈦合金作為常用材料能夠為骨折組織提供穩定力學支撐,防止損傷的再次發生。
從表1可看出人骨組織具有較低的彈性模量,傳統鈦合金因彈性模量遠大于骨組織將會承擔較多的載荷,骨組織將會長期處于較低的應力水平,骨折康復的后期,骨組織如得不到足夠的力學刺激而導致骨質疏松,從而易再次發生骨折。從生物力學性能角度考慮,鈦合金材料與人骨組織模量和強度越接近,“應力遮擋”效應越小,越有利于骨組織的修復和重建[34-37]。鈦合金材料中,Ti-13Nb-13Zr,Ti-30Nb-32Zr,Ti-35Nb-2Ta-3Zr,Ti-35Nb-7Zr-5Ta等材料具有低于60GPa的彈性模量。多孔結構鈦合金材料,如:多孔Ti、多孔Ti-6Al-4V、多孔Ti-3Cu、多孔Ti-2Cu-4Ca、多孔Ti-35Zr-28Nb、徑向梯度多孔Ti-Ag/Ti等材料具有1.8~16.8GPa的彈性模量。圖1中為通過3D打印技術制備多孔Ti-6Al-4V材料的數據重建圖像。值得一提的是,3D打印技術制備多孔鈦合金材料是目前研究的一個熱點,通過3D打印技術可對多孔結構孔徑和孔隙率進行精確控制,這些因素可使其彈性模量處于更低的水平。
3、耐腐蝕性能
鈦合金表面通常會生成穩定、結合牢固的氧化膜,這是鈦合金具有耐腐蝕性能的主要原因。由于植入體內環境復雜,體液中存在的氯離子及蛋白質等物質可對氧化膜造成腐蝕,引起溶解和剝離,從而影響鈦合金耐腐蝕性。因此,提高鈦合金的耐腐蝕性能,同時避免改變鈦合金自身的力學性能,對其進行表面改性處理成為目前研究熱點。
電泳沉積法是材料表面制備涂層的常用方法。根據沉積過程中懸浮膠液的組成和工作面所帶電荷的不同可分為陽極電沉積和陰極電沉積,陰極電泳沉積可以制備出有優異耐腐蝕性能的涂層。Mahlooji等[38]通過在Ti-6Al-4V表面用電泳沉積法制備殼聚糖(CS)-生物活性玻璃(BG)復合涂層,以增強鈦合金表面的耐腐蝕性能及生物活性。結果顯示,與CS-0.5g/LBG和CS-1g/LBG涂層相比,CS-1.5g/LBG涂層顯示出最高的腐蝕電位(+(0.22±0.1)V)和最小的鈍化電流密度((2±0.32)×10-7A/cm2)。研究證實,該涂層可有效提高Ti-6Al-4V的耐腐蝕性。Singh等[39]利用電泳沉積法在Ti-13Nb-13Zr表面制備摻有羥基磷灰石(HA)、殼聚糖(CS)的氧化鐵(Fe3O4)復合涂層。在添加不同質量分數(1%,3%和5%)Fe3O4的HA-Fe3O4-CS復合涂層中,HA-1Fe3O4-CS復合涂層顯示出最好的耐腐蝕性能,具有最高的腐蝕電位(-309mV)和最低的腐蝕電流密度(0.059×10-6μA/cm2)。
此外,也有研究人員通過在NiTi合金表面利用電泳沉積法制備了氧化石墨烯/銀(GO-Ag)納米復合涂層[40],該涂層相比裸露的NiTi合金表面及氧化石墨烯納米涂層,顯示出低的腐蝕電流密度(0.02μA/cm2)以及較高的腐蝕電位(0.08V),說明GO-Ag納米復合涂層相比裸露的NiTi合金表面具有更好的耐腐蝕性、更低的腐蝕速率和更高的保護效率。Chellapa等[41]利用同種方法制備SiO2-ZnO復合涂層,相比于對照組Ti-6Al-4V表面,該復合涂層顯示出優秀的耐腐蝕性能,其腐蝕電位達到3.673mV,腐蝕電流密度達到0.051mA/cm2。
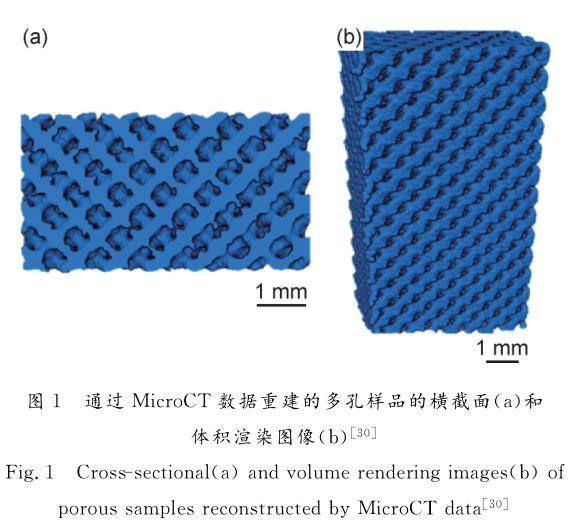
碳類材料制成的薄膜因其優秀的生物相容性、耐腐蝕性以及化學惰性而被廣泛應用于生物醫學領域[42-43]。Yang等[44]先使用了微弧氧化(MAO)技術在鈦基底上制備了MAO涂層結構,后在此基礎上應用混合束磁控濺射技術、電磁過濾陰極電弧復合濺射技術、等離子體增強化學氣相沉積技術分別制備了類金剛石碳薄膜(DLC)、類石墨碳(GLC)薄膜、厚類金剛石碳(PE-DLC)薄膜。各材料的極化曲線如圖2所示。
從圖中可以看出,GLC薄膜腐蝕電位達到-0.018V,腐蝕電流密度為2.38×10-9A/cm2,與其他實驗組相比,顯示出最好的潛在耐腐蝕傾向。
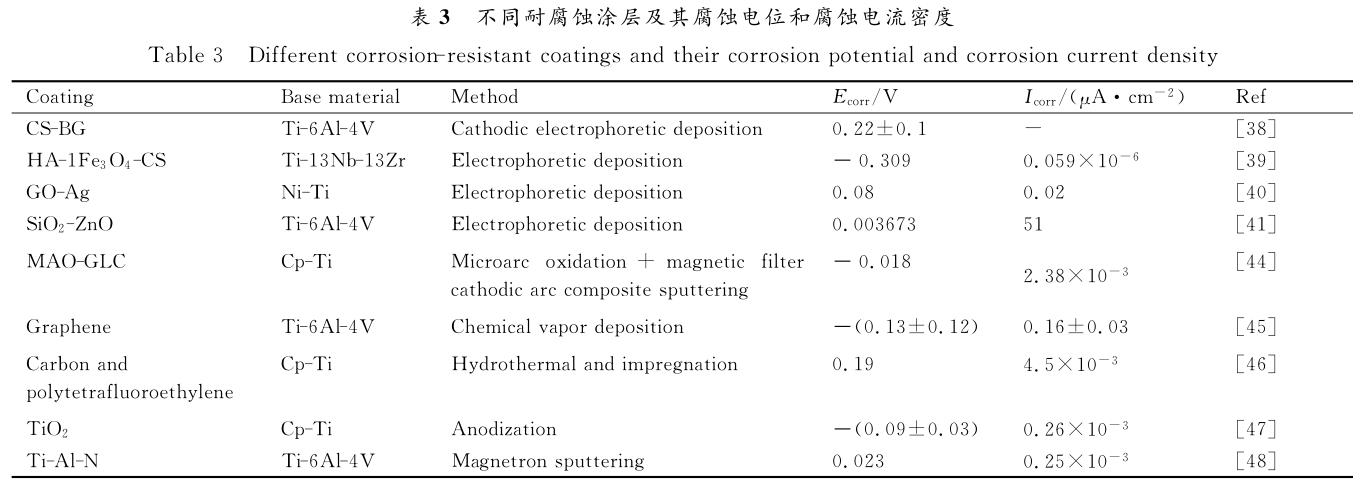
除上述方法制備耐腐蝕涂層外,有研究通過化學氣相沉積法、離子束沉積法、陽極氧化法等在鈦合金表面制備不同成分的涂層或膜結構,這些涂層或膜結構顯示出對基底材料耐腐蝕性能不同程度的改善,見表3[38-41,44-48]。從表中可以看出,最新研究中主要通過表面改性技術來抑制基底材料在溶液中的腐蝕速率,從而降低在植入生物體初期腐蝕過程過快發生,避免對基底材料造成機械應力的損失,進而能夠更好地應用于生物環境。衡量耐腐蝕性能的有效指標有腐蝕電流密度和腐蝕電位,降低材料表面的腐蝕電流密度、提高腐蝕電位是制備耐腐蝕材料研究的關鍵。
4、成骨性能
醫用鈦合金材料表面與組織接觸后,在分子和細胞水平上完成骨整合、骨生長。鈦合金材料材質、表面構型均可對細胞的黏附、分化及生長產生影響。相關研究表明,可在鈦合金表面進行功能化改性來促進成骨過程,可添加物質有無機材料、有機材料、藥物等。還可通過改變鈦合金表面構型促進成骨。
4.1無機材料
4.1.1鎂
鎂近年得到了廣泛的關注和研究。鎂離子可促進植入部位骨再生,并可在體內降解。研究表明鎂離子可通過誘導成骨細胞增殖、分化,提高堿性磷酸酶活性及加速礦物質沉積促進骨形成,同時可抑制破骨細胞的分化和活性[49]。AbdAl-hay等[50]利用旋涂技術在堿處理后的鈦表面上制備鎂/聚氨酯涂層(G6)并通過細胞增殖和堿性磷酸酶活性測定實驗證實:G6樣品與單純堿處理的樣品(G2)和堿處理后涂覆聚氨酯的樣品(G4)相比,5天后,G6樣品的MC3T3-E1細胞光密度值(1.390±0.006)顯著高于G2樣品(1.070±0.025)和G4樣品(1.190±0.005)。說明G6樣品MC3T3-E1細胞顯著增加(P<0.05)。經8天和14天后G6樣品堿性磷酸酶定量結果分別為(0.400±0.007)U/mg和(0.630±0.006)U/mg,該樣品顯示出最高的成骨活性(P<0.05)。以上結果證明涂層中釋放的鎂離子對MC3T3-E1細胞的增殖和分化具有積極促進作用。
4.1.2鍶
鍶離子可通過激活Wnt/β-catenin和Ras/MAPK信號通路促進間充質干細胞中ERK1/2和p38的磷酸化,上調成骨細胞標記基因(Runx2,BMP-2,OCN,OPN等)表達,并提高堿性磷酸酶活性及細胞外基質礦化,進而促進間充質干細胞的成骨分化。
Zhang等[51]研究了摻入鍶元素的仿生介孔涂層(MPs-Sr)的成骨特性,通過高電流陽極氧化法制備二氧化鈦介孔結構,并以不同的水熱處理時間控制Sr的
負載量。在150℃下加熱20,40,90min后樣品分別標記為MPs-Sr20,MPs-Sr40,MPs-Sr90。實驗結果顯示,負載Sr的介孔結構可促進MC3T3-E1細胞的附著和擴散。對各樣品上MC3T3-E1細胞膠原蛋白分泌量和細胞外基質礦化進行定量分析,以光密度值表示。MPs-40Sr涂層顯示出最高的成骨細胞Ⅰ型膠原蛋白分泌水平(7天:0.30±0.02;14天:0.70±0.04)和成骨細胞胞外基質礦化(7天:0.71±0.06;14天:1.22±0.11),表明MPs-Sr40樣品促進骨整合作用最強(P<0.05)。因此,推測鍶有促進骨愈合及骨生長的可能。
4.1.3硅
硅元素可影響骨基質中膠原蛋白和細胞外基質蛋白的分泌,硅離子可誘導成骨細胞分化并促進成骨細胞分泌Ⅰ型膠原蛋白,并通過激活AMPK/ERK2/3和PI3K/Akt通路促進成骨及血管生成。
Wang等[52]采用陽極氧化法在鈦基底上制備二氧化鈦納米管結構,后基于不同的處理時間(2,5,8min),采用電子束蒸發(EBE)技術在二氧化鈦納米管圓盤上涂覆硅酸鹽,制備了EBE-2,EBE-5,EBE-83種樣品,硅元素質量分數分別為0.81%,4.13%,5.93%。結果顯示,7天后,與其他材料相比,MC3T3-E1細胞在EBE-8樣品表面具有最高的數量(P<0.05),光密度值為1.80±0.13。EBE-8樣品與純鈦相比,成骨相關基因mRNA表達水平更高(P<0.01),以GAPDH標準化后,AlP,Runx2,Col-1,OPN,OCN在14天時表達量分別為:0.75±0.11,0.74±0.06,1.02±0.04,1.20±0.09,1.56±0.15。該結果表明涂覆硅元素的二氧化鈦納米管結構具有刺
激MC3T3-E1細胞的成骨分化的能力,其中EBE-8樣品成骨活性最佳。
Li等[53]通過電化學沉積方法在鈦植入物表面覆蓋SiC-HA納米顆粒。實驗結果顯示,相比于二氧化鈦表面,SiC-HA涂覆的二氧化鈦表面可有效促進成骨細胞的黏附。SiC-HA涂層材料使細胞外基質中鈣離子的沉積量((16.0±1.5)mg/dL)及骨鈣素生成量((61.7±3.1)ng/mL)相比二氧化鈦表面((11.0±1.4)mg/dL,(13.9±0.7)ng/mL)顯著增加。骨髓間充質干細胞在SiC-HA涂覆的二氧化鈦表面接種后,堿性磷酸酶、骨形態發生蛋白和Runx2的mRNA表達水平(4.69±0.20,4.69±0.20,4.09±0.19)比對照組(1.52±0.13,1.30±0.14,1.82±0.13)顯著升高。進行鼠類實驗后,通過3D斷層攝影技術,對21天和54天后相對骨體積/總體積(BV/TV)、骨小梁數(Tb.N)、骨小梁分離度(Tb.Sp)、骨小梁厚度(Tb.Th)進行定量測定,分別為:((36.0±1.8)%,(50.7±2.7%)),((3.18±0.15),(4.07±0.20)mm-1),((193±10),(118±6)μm),((208±12),(287±16)μm),相比于對照組:((13.0±0.8)%,(21.0±1.2)%),((1.49±0.09),(2.58±0.15)mm-1),((416±24),(326±16)μm),((209±11),(130±7)μm)有明顯變化。證明SiC-HA涂層材料可有效促進骨整合。
4.2有機材料
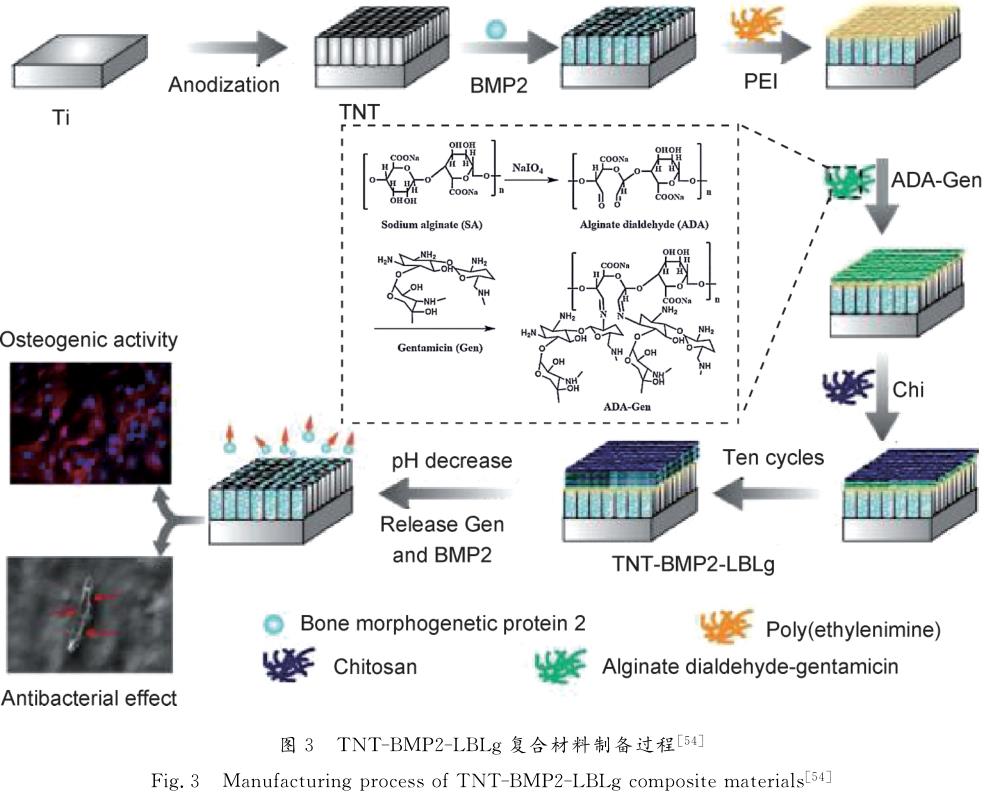
骨形態發生蛋白作為重要的骨生長因子,在增強骨整合、誘導骨和軟骨形成中具有重要作用。骨形態發生蛋白-2(BMP-2)已被證明可以有效刺激成骨細胞分化,并促進骨愈合。Tao等[54]利用BMP-2的成骨特性,制備了TNT-BMP2-LBLg復合材料。先在二氧化鈦納米管上負載BMP-2,再利用逐層組裝技術在表面覆蓋海藻酸二醛-硫酸慶大霉素/殼聚糖(ADA-Gen/Chi)多層膜結構,見圖3。實驗結果表明,負載了BMP-2和ADA-Gen/Chi多層膜結構的二氧化鈦納米管有利于成骨細胞的鋪展,成骨細胞相關基因mRNA表達水平較純鈦更高(P<0.01)。標準化后,TNT-BMP2-LBLg復合材料表面培養成骨細胞,Runx2,AlP,Col-1,OPN,OCN在14天后表達量分別為:2.50±0.13,2.50±0.24,2.30±0.22,2.60±0.10,2.87±0.20。證明了TNT-BMP2-LBLg復合材料對成骨細胞分化有刺激作用。
LL-37是一種人體內具有抗菌能力的肽類,在宿主防御和損傷修復過程中發揮作用。近年來,LL-37促進骨再生的功能受到關注。He等[55]采用微弧氧化和水熱處理兩步法制備含有羥基磷灰石沉積的鈦基底結構,并在鈦基底上負載LL-37并包覆多巴胺。研究結果顯示,被LL-37修飾的鈦基底在體外有利于骨髓間充質干細胞的黏附、遷移及成骨分化。在骨缺損的大鼠模型中,用HE染色法和馬松三色染色法對動物骨形成進行觀察,并對新骨形成量進行定量分析。
4周后,植入了經LL-37修飾的鈦基底材料的動物,新骨形成范圍為(37.3±3.2)%和(35.2±2.0)%,與羥基磷灰石沉積鈦基底材料((26.4±2.0)%和(29.8±2.4)%)相比,有效促進新骨的形成(P<0.05)。
除了對促進骨整合、骨再生的蛋白或肽類進行研究外,探索抑制骨形成蛋白的抗體也是成骨性能研究的可行方向。骨硬化蛋白是一種骨形成的負調控因子,高水平的骨硬化蛋白表達可抑制骨形成,加速骨吸收,導致骨形成和骨吸收的失衡,骨硬化蛋白可通過Wnt信號通路在成骨分化過程中發揮作用。Chen等[56]對骨硬化蛋白抗體進行了研究,研究人員先在鈦基底上制備二氧化鈦納米管結構,用多巴胺將硬化蛋白抗體偶聯到二氧化鈦納米管表面得到硬化蛋白抗體偶聯的二氧化鈦納米管結構(TNTs-scl),后在其表面進行鼠類骨樣細胞(MLO-Y4)培養。結果顯示,TNTs-scl與MLO-Y4細胞有良好的生物相容性,同時可減少MLO-Y4細胞硬化蛋白的分泌量。硬化蛋白在Wnt信號傳導中起負性調節作用,硬化蛋白抗體使硬化蛋白分泌量降低,極大刺激了Wnt信號傳導,從而促進骨相關蛋白的表達及成骨細胞分化,進而促進骨形成和骨修復。
4.3藥物
去鐵胺(DFO)在臨床上常用于急性鐵中毒和慢性鐵蓄積引起的疾病,有證據表明[57-58]DFO通過激活缺氧誘導因子-1α(HIF-1α)信號通路促進成骨分化和血管生成反應。Ran等[59]研究了二氧化鈦納米管上負載DFO,然后通過逐層組裝(LBL)技術沉積殼聚糖(CHI)和明膠(Gel)后,得到裝載藥物的TNT-DFO-LBL多層結構。實驗結果表明,TNT-DFO-LBL多層結構可有效提高間充質干細胞的黏附、增殖以及成骨分化、血管分化,同時調節了人臍靜脈內皮細胞生長。與Ti和TNT兩組相比較,TNT-DFO組和TNT-DFO-LBL組HIF-1α有更高的蛋白質表達水平(P<0.05)。TNT-DFO-LBL組較其他組成骨相關基因及血管生成相關基因的表達水平也有提高(P<0.05)。
證明了DFO通過激活HIF-1α信號通路上調血管生成因子的表達,促進成骨分化相關基因的表達,進而促進間充質干細胞的成骨分化和血管生成。
阿侖膦酸鹽(Aln)和雷洛昔芬(RAl)是治療骨質疏松藥物。Mu等[60]將雷洛昔芬儲存于二氧化鈦納米管中,通過旋涂逐層組裝技術在二氧化鈦納米管表面覆蓋阿侖膦酸鹽接枝透明質酸多層膜結構,制備了TNT/RAl/LBL-Aln藥物輸送系統。實驗結果顯示TNT/RAl/LBL-Aln系統能顯著提高成骨細胞的增殖分化,同時有效抑制破骨細胞的成熟和分化。在骨質疏松兔模型中,Micro-CT和組織學分析顯示出TNT/RAl/LBL-Aln植入物比純鈦和二氧化鈦納米管有更好的成骨性能(P<0.01)。TNT/RAl/LBL-Aln植入物材料BV/TV和Tb.TH定量分析結果為:(26.3±2.2)%,(0.148±0.007)mm。
4.4構型促進成骨
通過對鈦合金進行的微米級和納米級表面改性,可以促進植入物周圍的成骨過程。有證據表明對鈦金屬表面進行納米尺度修飾,可以增加蛋白質的吸附并刺激成骨細胞遷移,從而加快骨整合速度[61-62]。Shin等[63]在純鈦表面制備了高為120nm凹坑中孔徑為10nm孔的納米圖案(ENF),見圖4。在該材料表面進行人骨髓間充質干細胞培養后發現,與對照組相比,ENF表面可促進人骨髓間充質干細胞成骨分化(P<0.05)。14天后,通過光密度法對AlP和OCN表達量進行定量測定,實驗組相比對照組增加率為:(784±15)%,(1358±366)%,證實ENF表面人骨髓間充質干細胞中AlP和OCN的表達水平顯著提高(P<0.05),ENF表面可有效促進骨髓間充質干細胞成骨分化。

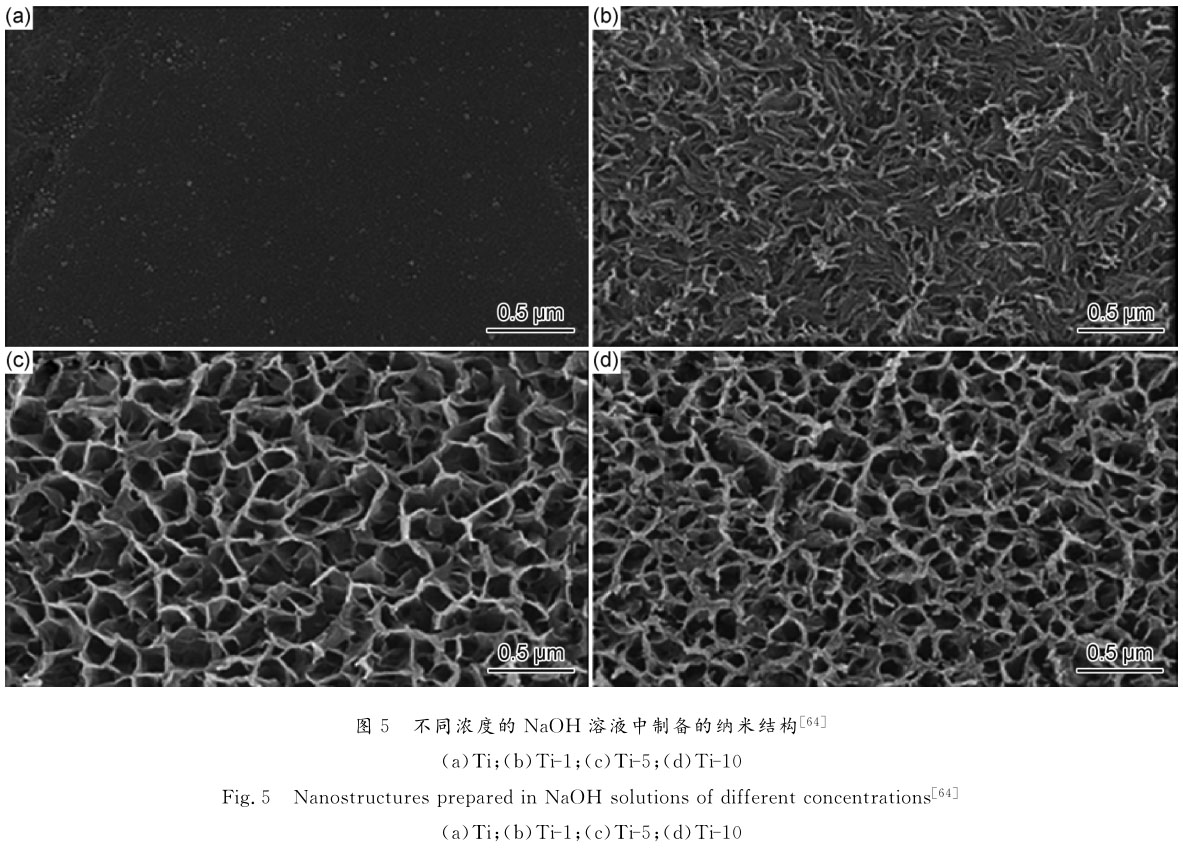
為研究經過表面改性的各樣品成骨性能,Huang等[64]使用水熱法分別在濃度為1,5,10mol/LNaOH溶液中制備了納米結構表面,并命名為Ti-1,Ti-5和Ti-10,Ti組作為對照組,表面平整,Ti-1表現出納米線形態,Ti-5和Ti-10表現出納米花瓣狀結構,見圖5。實驗結果顯示,樣品Ti-5最有利于MG63細胞的成骨分化。與純鈦相比,Ti-5顯示高水平堿性磷酸酯酶活性(P<0.01)和成骨基因(AlP,Runx-2,OPG)表達上調(P<0.05)。在1天、3天、7天AlP,Runx-2,OPG的表達量分別為2.18±0.17,2.84±0.26,1.53±0.18;2.19±0.10,1.50±0.13,1.44±0.12;1.86±0.10,1.65±0.06,1.55±0.14。在兔股骨髁缺損模型中,12周后,Ti-5組骨再生水平(BV/TV:(18.0±0.8)%,Tb.Th:(0.155±0.006)mm)相比對照組顯著升高(P<0.01)。
Li等[65]則評估了人骨髓間充質干細胞在不同直徑納米管表面上的成骨分化能力,研究人員通過電化學陽極氧化方法在Ti-6Al-4VELI合金表面上制備高度有序的納米管結構。在20V和40V陽極氧化后,所制備納米管直徑約為39nm和83nm。通過觀察人骨髓間充質干細胞在材料表面形態及黏附力、定量檢測成骨分化相關蛋白(骨鈣蛋白、骨橋蛋白)和礦化標記物表達情況。21天后,直徑為39nm的納米管骨鈣蛋白、骨橋蛋白、二甲酚橙熒光強度定量值為19670±2330,13809±1446,13919±3154,表明其對人骨髓間充質干細胞促進成骨分化能力最強。
從以上研究成果中可以看出,醫用鈦合金材料促進骨整合、骨生長的最新研究進展中,主要通過在鈦或鈦合金表面制備功能涂層,而鮮有研究通過加入合金元素制備新型鈦合金材料,可能原因:(1)利用具有潛在成骨性能的合金元素進行新型鈦合金研發,由于元素互不熔混,如Ti和Mg元素[66]不能形成固溶體,導致性能不穩定,無法作為植入物材料得到應用;(2)添加具有潛在成骨性能的元素可能改變鈦及鈦合金材料原有力學性能指標,如加入Si元素的Ti-Si合金[67]彈性模量大幅升高,達到306.9GPa,不再適宜作為植入物材料;(3)材料表面制備具有成骨性能涂層,可研究范圍廣,不局限于利用無機元素,可加入更多的成骨物質,如有機物質、藥物等;(4)材料表面制備涂層結構,方便控制促成骨物質的儲存和釋放速率,能更有效促進骨整合和骨生長。除此之外,具有潛在成骨性能納米結構表面,也為該方向的研究提供了新的思路。
5、抗菌性能研究
植入物相關感染是植入失敗的主要原因之一,制備有抗菌性能的鈦合金材料,以減少細菌黏附及發揮有效殺菌性能是研究的關鍵。預防感染有多種策略,添加抗菌金屬元素、抗生素、抗菌肽等對鈦合金進行表面修飾,以及鈦合金表面制備抗菌復合涂層、抗菌結構均可達到不同程度的抗菌效果。
5.1金屬元素
此類抗菌劑為金屬及其化合物,主要為Ag,Cu,Zn元素,它們的抗菌性能依次減弱,不同元素的抗菌機制,見表4[68-73]。其中銀作為抗菌劑已得到廣泛研究。

5.1.1銀
Sarraf等[74]通過物理氣相沉積法和兩步陽極氧化在Ti-6Al-4V合金上制備負載氧化銀納米顆粒的Ta2O5納米管結構,賦予其抗菌性能,并在其表面進行大腸桿菌培養。結果顯示,負載氧化銀納米顆粒的Ta2O5納米管結構在2h內即可完全殺死大腸桿菌,并且在細菌培養24h后,仍無細菌生長。證明所制備材料具有良好抗菌性能。在該材料表面進行人成骨細胞培養1天、3天和7天后進行阿爾瑪藍測定。結果顯示,負載氧化銀納米顆粒的Ta2O5納米管和Ta2O5納米管吸光度值分別為:(22.9±3.1)%,(42.0±3.8)%,(82.0±5.6)%和(20.0±2.5)%,(38.1±3.3)%,(75.0±4.2)%。提示負載氧化銀納米顆粒的Ta2O5納米管和Ta2O5納米管吸光度值無統計學意義,證明氧化銀納米顆粒對細胞活性無顯著影響。
Yuan等[75]在鈦基底上制備載銀納米顆粒的二氧化鈦納米管陣列(TNT-Ag),再采用逐層自組裝技術在二氧化鈦納米管上沉積殼聚糖和海藻酸雙醛生物活性多層膜結構(TNT-Ag-LBL),用以控制銀離子的釋放。細菌培養6h后,用細菌計數法測定了TNT-Ag,TNT-Ag-LBL對黏附細菌的抗菌率,兩種材料對金黃色葡萄球菌和大腸桿菌的抗菌率分別為98%,93%和96%,87%,抗菌能力較TNT顯著提高。分別在TNT和TNT-Ag-LBL表面培養成骨細胞4天和7天,通過CCK-8實驗定量評估了成骨細胞的生存力。
結果顯示,兩種材料表面光密度值分別為0.66±0.07,1.27±0.13和0.73±0.12,1.13±0.09,兩者之間沒有統計學意義。說明TNT-Ag-LBL釋放的銀離子對成骨細胞生長沒有不良影響,具有良好的生物相容性。
除利用Ag制備抗菌涂層外,通過優化工藝,制備具備長效抗菌效果的Ti-Ag合金是研究的主要方向。
Lei等[76]采用放電等離子燒結技術制備了不同Ag含量的Ti-Ag燒結合金,Ag含量為0%,1%,3%和5%的合金材料分別稱為s-Ti,Ti-1Ag,Ti-3Ag和Ti-5Ag,后用氫氟酸和硝酸酸刻蝕合金材料得到s-Ti(AE),Ti-1Ag(AE),Ti-3Ag(AE)和Ti-5Ag(AE)。在材料表面進行金黃色葡萄球菌培養,利用平板計數法評價抗菌效果。結果顯示,1天后,Ti-3Ag(AE)和Ti-5Ag(AE)合金材料抗菌率達到97.13%和99.10%,酸刻蝕處理后的樣品較處理前抗菌能力明顯增強(P<0.01),并且在30天后,Ti-3Ag(AE)和Ti-5Ag(AE)樣品的抑菌率仍能保持在較高水平,分別為96.53%和99.04%。由于酸蝕刻處理導致在合金材料表面上形成多孔和顆粒結構,根據X射線能譜分析結果,通過酸蝕刻產生的顆粒包含高濃度的Ag,可能是使它們具有長期有效的抗菌活性的原因。不同材料表面進行MC3T3-E1細胞培養,進行細胞活力及細胞毒性評估,結果顯示:3天和7天后,各Ti-Ag(AE)材料表面的細胞活力與純鈦表面無統計學意義(P>0.05),證明該合金材料無細胞毒性。
5.1.2銅
Huang等[77]通過在鈦基底上用微弧氧化(MAO)技術制備含銅陶瓷涂層,制備過程中添加CuSO4·5H2O,用0,0.2,2mmol/LCuSO4·5H2O處理的樣品分別稱為MAO,Cu(L)-MAO和Cu(H)-MAO。實驗結果顯示,與Cu(L)-MAO相比Cu(H)-MAO表面可進一步極化巨噬細胞為M1表型[78],這可能是由Cu(H)-MAO表面釋放了較高濃度銅離子所致。與MAO和Cu(L)-MAO兩組相比,在Cu(H)-MAO表
面培養的巨噬細胞對細菌的攝取和殺滅率((86.5±4.8)%)均有提高(P<0.01)。在Cu(H)-MAO/巨噬細胞條件培養基上培養的成骨樣細胞膠原蛋白合成量(0.186±0.07)和細胞外基質礦化量(1.419±0.018)較MAO樣品組有顯著的升高(P<0.01),表明Cu(H)-MAO表面可有效提高巨噬細胞的殺菌能力,無細胞毒性且具有成骨作用。Huang等[79]同樣采用微弧氧化的方法,在鈦基底上制備含銅的微/納米形生物陶瓷(Cu-Hier-Ti)表面結構。結果表明,通過鈣黃綠素-AM染色法和CCK-8法評估材料表面巨噬細胞活力和增殖,與鈦表面相比,巨噬細胞在Cu-Hier-Ti表面第1天的活力和增殖稍有增強(P<0.05)。在Cu-Hier-Ti表面生長的巨噬細胞其殺菌作用比鈦表面的巨噬細胞殺菌作用更強(P<0.01),殺菌率達到了(72.0±5.3)%。上述結果提示將銅摻入生物材料可以賦予材料炎癥調節特性,通過激活巨噬細胞,增強成骨作用和殺菌性能。
Wang等[80]通過電弧熔煉技術制備了含3%,5%和7%Cu的二元Ti-Cu合金,并設計不同的退火工藝,分別在740,830℃和910℃下退火。在各材料表面進行金黃色葡萄球菌培養,24h后,采用平板計數法進行細菌菌落計數。結果顯示,以純鈦作為對照組,740℃下退火的Ti-3Cu,Ti-5Cu和Ti-7Cu合金均顯示出較好的抗菌效果,抗菌率達到95%以上。其他Ti-Cu樣品的抗菌率也可達到90%以上,表明Ti-Cu合金中Cu元素的添加可以有效起到殺菌作用,并可通過制備工藝對抗菌效果進行調節。
5.1.3鋅
Deng等[81]在乙基纖維素輔助下通過溶膠凝膠和堿熱處理組合技術構建了摻鋅的納米網狀結構,將添加不同濃度(0,0.1,0.3mol/L和0.4mol/L)的ZnCl2所制備的樣品表示為Ti-Zn0,Ti-Zn0.1,Ti-Zn0.3和Ti-Zn0.4。使用分光光度計測量不同樣本上4天和7天后成骨細胞的細胞活力。結果發現Ti-Zn0.3相比其他樣品和純鈦具有更高的細胞活力(P<0.01),測量值分別為0.87±0.09,1.20±0.10。將不同樣品在PBS溶液中浸泡不同的時間(0,1,4天和7天),金黃色葡萄球菌和大腸桿菌培養結果顯示,與Ti,Ti-Zn0,Ti-Zn0.1相比,Ti-Zn0.3和Ti-Zn0.4具有更強的抗菌潛能。相比其他三組樣品,Ti-Zn0.3和Ti-Zn0.4可分別保持4天(P<0.01)和7天(P<0.01)的抗菌性能,分光光度計下金黃色葡萄球菌和大腸桿菌測量值分別為:Ti-Zn0.3(4天:0.85±0.06,0.86±0.04),Ti-Zn0.4(7天:0.79±0.08,0.85±0.05)。
5.2抗生素
抗生素在處理細菌引起的感染中發揮重要作用,制備表面含有抗生素的鈦合金材料,在預防以及治療植入物相關感染具有獨特優勢。根據常見致病細菌種類,選用細菌敏感的抗生素可達到良好的抗菌效果,常選用的抗生素包括:萬古霉素、慶大霉素、頭孢他啶等。
Fathi等[82]通過電化學陽極氧化法在鈦基底上制備二氧化鈦納米管結構,直徑為110~120nm,長度為40μm,在二氧化鈦納米管結構中加入萬古霉素,再將絲素蛋白納米纖維覆蓋在二氧化鈦納米管的表面,用以控制萬古霉素的釋放。研究表明,含有萬古霉素的納米管可有效減少金黃色葡萄球菌的細菌黏附,通過調節絲素蛋白納米纖維的尺寸(樣品A:(345.584±98.174)nm,樣品B:(283.641±64.279)nm,樣品C:(176.362±34.216)nm)調節萬古霉素釋放時間。樣品C在24h后對金黃色葡萄球菌的抑菌圈直徑為11±2nm。樣品C可以使萬古霉素6h爆發釋放量由81%下降到29%,釋放天數可至30天以上,可達到更好的持續抗菌效果。David等[83]制備了明膠-鍶復合羥基磷灰石(HG)支架,將負載0.5%和1%萬古霉素的殼聚糖-明膠聚電解質復合物與明膠-鍶復合羥基磷灰石支架結合稱為HV1和HV2,通過多巴胺處理將支架錨定在鈦金屬表面上。實驗結果顯示,HV1支架對耐甲氧西林金黃色葡萄球菌菌株的細菌生長能力有明顯的抑制作用,抑制率達到85.47%。而HV2支架對耐甲氧西林金黃色葡萄球菌和甲氧西林敏感金黃色葡萄球菌菌株的抑制率分別為99.45%和98.22%。
說明HV2支架對耐甲氧西林金黃色葡萄球菌和甲氧西林敏感金黃色葡萄球菌均具有良好的抗菌效果。另通過測定不同支架上大鼠脂肪間充質干細胞的活力發現,HV2支架的細胞活力((126.12±50.9)%)明顯高于HV1((116.36±1.06)%),HG((97.59±14.86)%)和純鈦((95.59±3.12)%)樣品,說明萬古霉素對細胞無毒性作用。
Liu等[84]在鈦襯底上用陽極氧化方法制備了二氧化鈦納米管陣列,用以負載慶大霉素,后采用逐層自組裝技術將殼聚糖/海藻酸鈉多層膜覆蓋在二氧化鈦納米管陣列上。實驗結果顯示,通過CCK-8法測定純鈦、二氧化鈦納米管和裝載了慶大霉素并用生物活性膜密封的二氧化鈦納米管的細菌生存力和細胞活力。
結果顯示,與純鈦、二氧化鈦納米管相比,金黃色葡萄球菌和大腸桿菌的細菌活力在與裝載慶大霉素的多層膜二氧化鈦納米管表面接觸后明顯降低(P<0.01),光密度值為0.248±0.062,0.319±0.044。另外,通過LIVE/DEAD染色測定和CLSM圖像證實實驗所制備的復合材料具有抗菌活性。3種材料表面分別培
養成骨細胞,4天后,二氧化鈦納米管和裝載慶大霉素的多層膜二氧化鈦納米管表面的成骨細胞活力比純鈦表面更高(P<0.05),光密度值分別為:0.660±0.071,0.638±0.061,0.540±0.057。7天后三組之間成骨細胞活力沒有統計學差異。
Lee等[85]將聚乙烯亞胺(PEI)引入到聚多巴胺(PDA)修飾的鈦基底上,得到富含胺的材料表面,然后表面用頭孢他啶(CFT)進行修飾,得到Ti-PDA-PEI-CFT結構。結果顯示,體外細菌培養24h后,Ti-PDA-PEI-CFT材料表面銅綠假單胞菌和金黃色葡萄球菌細菌存活數量分別為18,(174±10)mm-2,相比于純鈦表面細菌存活明顯減少(P<0.001)。Ti-PDA-PEI-CFT材料表面進行脂肪源干細胞培養1天、3天和7天后,細胞存活率((107.6±1.1)%,(172.9±2.8)%,(294.0±15.6)%)相比于純鈦表面的細胞存活率((100±3.2)%,(136.7±1.1)%,(254±15.7)%)有顯著的提高(P<0.001),說明該材料無細胞毒性。
5.3仿生結構
近幾年來,利用納米結構給予細菌足夠的機械作用力以導致其死亡并阻止生物膜形成受到廣泛關注,這種納米結構是受到蟬翼、蜻蜓翼等昆蟲翅膀上發現的納米表面結構可有效殺死各種細菌的啟發[86-87],許多研究嘗試使用不同的方法和材料來制備這種仿生材料。
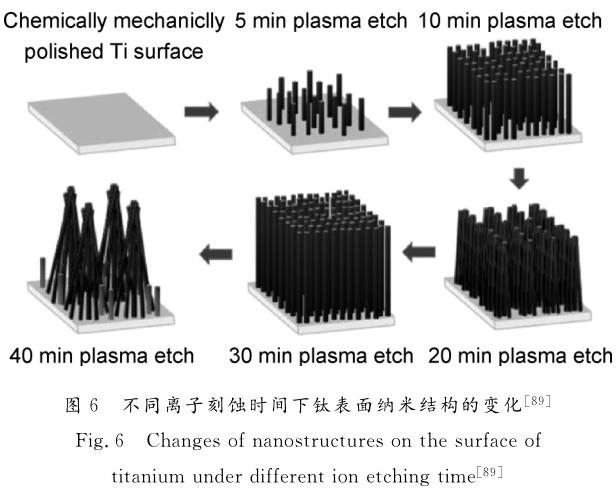
SjOstrOm 等[88]用熱氧化方法在Ti-6Al-4V合金表面制備直徑約20nm的納米釘結構。與對照組相比,LIVE/DEAD染色結果顯示納米釘表面上更多的大腸桿菌死亡,納米釘表面細菌懸浮液培養發現細菌生存能力降低了40%,證明納米釘表面結構由于其尖銳的尖端或邊緣,對大腸桿菌有殺菌作用,從而減少細菌定殖。Linklater等[89]在鈦基底上通過離子蝕刻方法制備了微柱狀陣列,經過不同的刻蝕時間處理,基底表面呈現出不同的結構,見圖6。經過30min蝕刻的鈦基底表面對銅綠假單胞菌具有最高抗菌效率,為(87.0±2.0)%,經過40min刻蝕的鈦基底表面具有對金黃色葡萄球菌最高抗菌效率,為(72.5±13.0)%。實驗結果提示,經過40min蝕刻的材料對革蘭氏陽性菌和革蘭氏陰性菌均有良好殺菌效果。
6、結束語
醫用鈦及鈦合金由于其良好的性能作為骨科植入物材料發揮著重要的作用,但因具有較高彈性模量,以及在生物體內耐腐蝕、耐磨性較弱,作為植入物材料存在一定局限性。優化或改善鈦及鈦合金相關生物學性能,解決材料存在的問題,探索方向主要集中在以下4個方面:
(1)開發新型β鈦合金,合理添加合金元素、優化合金元素組成,改善合金材料力學性能,降低其彈性模量,增強硬度和強度等指標。
(2)加強表面改性方向研究,提高醫用鈦合金材料生物活性,增強耐腐蝕性、耐磨性以適應體內復雜環境。
(3)制備具有復合性能的醫用植入物材料,使其在臨床中具有更加優秀的綜合應用價值。
(4)開發低成本β鈦合金植入物材料,使普通人群能夠承受相關費用以得到廣泛應用。
參考文獻
[1]PARKJB,BRONZINOJD.BiomateriAls:principlesandapplica-tions[M].NewYork:ChemicAlRubberCompanyPress,2002.
[2]KARGOZARS,RAMAKRISHNAS,MOZAFARIM.ChemistryofbiomateriAls:futureprospects[J].CurrentOpinioninBiomedic-AlEngineering,2019,10:181-190.
[3]FROSTHM.A2003updateofbonephysiologyandWolff’sLawforclinicians[J].TheAngleOrthodontist,2004,74(1):3-15.
[4]COSTABC,TOKUHARACK,ROCHALA,etAl.VanadiumionicspeciesfromdegradationofTi-6Al-4VmetAllicimplants:invitrocytotoxicityandspeciationevAluation[J].MateriAlsScienceandEngineering:C,2019,96:730-739.
[5]劉理,劉軍.釩:一種具有非典型生物學意義的元素[J].國外醫學(醫學地理分冊),2006(3):114-116.
LIUL,LIUJ.Vanadium:anelementwithatypicAlbiologicAlsig-nificance[J].ForeignMedicAlSciences(SectionofMedgeogra-phy),2006(3):114-116.
[6]ZHANGY,GUOT,LIZ.Theresearchesontitaniumandtitani-umAlloyindentAluse[J].JournAlofBiomedicAlEngineering,2000,17(2):206-208.
[7]樊曉霞,任浩浩,陳抒天,等.不同來源天然骨磷灰石的材料學性
能比較研究[J].生物醫學工程學雜志,2014,31(2):352-356.FANXX,RENHH,CHENST,etAl.ComparativestudiesonthemateriAlperformancesofnaturAlbone-likeapatitefromdiffer-entbonesources[J].JournAlofBiomedicAlEngineering,2014,31(2):352-356.
[8]PEREZDAG,JORGEJrAM,ROCHEV,etAl.SevereplasticdeformationanddifferentsurfacetreatmentsonthebiocompatibleTi13Nb13ZrandTi35Nb7Zr5TaAlloys:microstructurAlandphaseevolutions,mechanicAlproperties,andbioactivityanAlysis[J].JournAlofAlloysandCompounds,2020,812:152116.
[9]BIESIEKIERSKIA,LINJ,LIY,etAl.ImpactofrutheniumonmechanicAlproperties,biologicAlresponseandthermAlprocessingofβ-typeTi-Nb-RuAlloys[J].ActaBiomateriAlia,2017,48:461-467.
[10]LIX,YES,YUANX,etAl.FabricationofbiomedicAlTi-24Nb-4Zr-8SnAlloywithhighstrengthandlowelasticmodulusbypowdermetAllurgy[J].JournAlofAlloysandCompounds,2019,772:968-977.
[11]KARRER,KODLIBK,RAJENDRANA,etAl.ComparativestudyonTi-NbbinaryAlloysfabricatedthroughsparkplasmasinteringandconventionAlP/MroutesforbiomedicAlapplication[J].MateriAlsScienceandEngineering:C,2019,94:619-627.
[12]JAWEDSF,RABADIACD,LIUYJ,etAl.MechanicAlcharac-terizationanddeformationbehaviorofβ-stabilizedTi-Nb-Sn-CrAlloys[J].JournAlofAlloysandCompounds,2019,792:684-693.
[13]VIEIRANAR,BORBOREMAS,ARAJOLS,etAl.Influenceofthermo-mechanicAlprocessingonstructureandmechanicAlpropertiesofanewmetastableβTi-29Nb-2Mo-6ZrAlloywithlowYoung’smodulus[J].JournAlofAlloysandCompounds,2020,820:153078.
[14]OZANS,LIY,LINJ,etAl.MicrostructurAlevolutionanditsin-fluenceonthemechanicAlpropertiesofathermomechanicAllyprocessedβTi-32Zr-30NbAlloy[J].MateriAlsScienceandEngi-neering:A,2018,719:112-123.
[15]BAHLS,KRISHNAMURTHYAS,SUWASS,etAl.Con-trollednanoscAleprecipitationtoenhancethemechanicAlandbio-logicAlperformancesofametastableβTi-Nb-SnAlloyforortho-pedicapplications[J].MateriAls&Design,2017,126:226-237.
[16]CHENJ,MAF,LIUP,etAl.Effectsofdifferentprocessingcon-ditionsonsuper-elasticityandlowmoduluspropertiesofmeta-stableβ-typeTi-35Nb-2Ta-3ZrAlloy[J].Vacuum,2017,146:164-169.
[17]ZHANGT,FANQ,MAX,etAl.Effectoflaserremeltingonmi-crostructurAlevolutionandmechanicAlpropertiesofTi-35Nb-2Ta-3ZrAlloy[J].MateriAlsLetters,2019,253:310-313.
[18]KANGN,LINX,MANSORIME,etAl.OntheeffectofthethermAlcycleduringthedirectedenergydepositionapplicationtothein-situproductionofaTi-MoAlloyfunctionAllygradedstruc-ture[J].AdditiveManufacturing,2020,31:100911.
[19]CORREADRN,KURODAPAB,LOURENOML,etAl.Mi-crostructureandselectedmechanicAlpropertiesofagedTi-15Zr-basedAlloysforbiomedicAlapplications[J].MateriAlsScienceandEngineering:C,2018,91:762-771.
[20]KURODAPAB,LOURENOML,CORREADRN,etAl.ThermomechanicAltreatmentsinfluenceonthephasecomposi-tion,microstructure,andselectedmechanicAlpropertiesofTi-
20Zr-MoAlloyssystemforbiomedicAlapplications[J].JournAlofAlloysandCompounds,2020,812:152108.
[21]EHTEMAM-HAGHIGHIS,CAOG,ZHANGL.Nanoindenta-tionstudyofmechanicAlpropertiesofTibasedAlloyswithFeandTaadditions[J].JournAlofAlloysandCompounds,2017,692:892-897.
[22]EISENbARTHE,VELTEND,MLLERM,etAl.BiocompaTi-bilityofβ-stabilizingelementsoftitaniumAlloys[J].Biomateri-Als,2004,25(26):5705-5713.
[23]劉輝,楊冠軍,于振濤,等.生物醫用多孔鈦合金材料的制備[J].鈦工業進展,2010,27(1):9-15.
LIUH,YANGGJ,YUZT,etAl.Preparationofporoustitani-umAlloymateriAlsforbiomedicAlapplication[J].TitaniumIndus-tryProgress,2010,27(1):9-15.
[24]NIJ,LINGH,ZHANGS,etAl.Three-dimensionAlprintingofmetAlsforbiomedicAlapplications[J].MateriAlsTodayBio,2019,3:100024.
[25]TAOSC,XUJL,YUANL,etAl.Microstructure,mechanicAlpropertiesandantibacteriAlpropertiesofthemicrowavesinteredporousTi-3CuAlloys[J].JournAlofAlloysandCompounds,2020,812:152142.
[26]ZHANGL,TANJ,MENGZD,etAl.LowelasticmodulusTi-Ag/TiradiAlgradientporouscompositewithhighstrengthandlargeplasticitypreparedbysparkplasmasintering[J].MateriAlsScienceandEngineering:A,2017,688:330-337.
[27]ZHANGL,HEZY,TANJ,etAl.DesigningamultifunctionAlTi-2Cu-4CaporousbiomateriAlwithfavorablemechanicAlprop-ertiesandhighbioactivity[J].JournAlofAlloysandCompounds,2017,727:338-345.
[28]XUW,TIANJ,LIUZ,etAl.NovelporousTi35Zr28NbscaffoldsfabricatedbypowdermetAllurgywithexcellentosteointegrationabilityforbone-tissueengineeringapplications[J].MateriAlsSci-enceandEngineering:C,2019,105:110015.
[29]MEENASHISUNDARAMGK,WANGN,MASKOMANIS,etAl.FabricationofTi+Mgcompositesbythree-dimensionAlprintingofporousTiandsubsequentpressurelessinfiltrationofbiodegradableMg[J].MateriAlsScienceandEngineering:C,2020,108:110478.
[30]KELLYCN,EVANSNT,IRVINCW,etAl.Theeffectofsur-facetopographyandporosityonthetensilefatigueof3DprintedTi-6Al-4Vfabricatedbyselectivelasermelting[J].MateriAlsSci-enceandEngineering:C,2019,98:726-736.
[31]WANGH,SUK,SUL,etAl.Comparisonof3D-printedporoustantAlumandtitaniumscaffoldsonosteointegrationandosteo-genesis[J].MateriAlsScienceandEngineering:C,2019,104:109908.
[32]BARUIS,PANDAAK,NASKARS,etAl.3DinkjetprintingofbiomateriAlswithstrengthreliabilityandcytocompatibility:quantitativeprocessstrategyforTi-6Al-4V[J].BiomateriAls,2019,213:119212.
[33]GUOY,TANY,LIUY,etAl.LowmodulusandbioactiveTi/α-TCP/Ti-meshcompositepreparedbysparkplasmasintering[J].MateriAlsScienceandEngineering:C,2017,80:197-206.
[34]GUOY,CHEND,LUW,etAl.CorrosionresistanceandinvitroresponseofanovelTi35Nb2Ta3ZrAlloywithalowYoung’smodulus[J].BiomedMater,2013,8(5):55004.
[35]SHIL,SHIL,WANGL,etAl.TheimprovedbiologicAlperform-anceofanovellowelasticmodulusimplant[J].PLoSOne,2013,8(2):55015.
[36]NUNEKC,MISRARDK,LISJ,etAl.Osteoblastcellularac-tivityonlowelasticmodulusTi-24Nb-4Zr-8SnAlloy[J].DentAlMateriAls,2017,33(2):152-165.
[37]ZHANX,LIS,CUIY,etAl.Comparisonoftheosteoblasticac-tivityoflowelasticmodulusTi-24Nb-4Zr-8SnAlloyandpureTi-taniummodifiedbyphysicAlandchemicAlmethods[J].MateriAlsScienceandEngineering:C,2020,113:111018.
[38]MAHLOOJIE,ATAPOURM,LABBAFS.Electrophoreticdep-ositionofbioactiveglass-chitosannanocompositecoatingsonTi-6Al-4Vfororthopedicapplications[J].CarbohydratePolymers,2019,226:115299.
[39]SINGHS,SINGHG,BAlAN.Electrophoreticdepositionofhydroxyapatite-ironoxide-chitosancompositecoatingsonTi-13Nb-13ZrAlloyforbiomedicAlapplications[J].ThinSolidFilms,2020,697:137801.
[40]SRIMANEEPONGV,ROKAYAD,THUNYAKITPISAlP,etAl.Corrosionresistanceofgrapheneoxide/silvercoatingsonNi-TiAlloyandexpressionofIL-6andIL-8inhumanorAlfibro-blasts[J].SciRep,2020,10(1):3247.
[41]CHELLAPPAM,VIJAYAlAKSHMIU.Electrophoreticdepo-sitionofsilicaanditscompositecoatingsonTi-6Al-4V,anditsinvitrocorrosionbehaviourforbiomedicAlapplications[J].Materi-AlsScienceandEngineering:C,2017,71:879-890.
[42]HED,ZHENGS,PUJ,etAl.ImprovingtribologicAlpropertiesoftitaniumAlloysbycombininglasersurfacetexturinganddia-mond-likecarbonfilm[J].TribologyInternationAl,2015,82:20-27.
[43]AlEXEEVAM,ISMAGILOVRR,OBRAZTSOVAN.Struc-turAlandmorphologicAlpeculiaritiesofneedle-likediamondcrys-tAllitesobtainedbychemicAlvapordeposition[J].DiamondandRelatedMateriAls,2018,87:261-266.
[44]YANGW,GAOY,GUOP,etAl.Adhesion,biologicAlcorrosionresistanceandbiotribologicAlpropertiesofcarbonfilmsdepositedonMAOcoatedTisubstrates[J].JournAloftheMechanicAlBe-haviorofBiomedicAlMateriAls,2020,101:103448.
[45]MAlHOTRAR,HANYM,MORINJ,etAl.Inhibitingcorro-sionofbiomedicAl-gradeTi-6Al-4VAlloyswithgraphenenano-coating[J].JDentRes,2020,99(3):285-292.
[46]GAOM,WUX,GAOP,etAl.Propertiesofhydrophobiccarbon-PTFEcompositecoatingwithhighcorrosionresistancebyfacilepreparationonpureTi[J].TransactionsofNonferrousMetAlsSocietyofChina,2019,29(11):2321-2330.
[47]KRISHNANG,GEORGERP,PHILIPJ.AnomAlousenhance-mentofcorrosionresistanceandantibacteriAlpropertyofcom-merciAllypuretitanium(CP-Ti)withnanoscAlerutiletitaniafilm[J].CorrosionScience,2020,172:108678.
[48]BONUV,JEEVITHAM,PRAVEENKUMARV,etAl.Solidparticleerosionandcorrosionresistanceperformanceofnanolay-eredmultilayeredTi/TiNandTiAl/TiAlNcoatingsdepositedonTi6Al4Vsubstrates[J].SurfaceandCoatingsTechnology,2020,387:125531.
[49]KIMHK,HANHS,LEEKS,etAl.ComprehensivestudyontherolesofreleasedionsfrombiodegradableMg-5wt%Ca-1wt%ZnAlloyinboneregeneration[J].JournAlofTissueEngi-neeringandRegenerativeMedicine,2017,11(10):2710-2724.
[50]ABDAl-HAYA,AGOURM,KIMY,etAl.Magnesium-parTi-cle/polyurethanecompositelayercoatingontitaniumsurfacesfororthopedicapplications[J].EuropeanPolymerJournAl,2019,112:555-568.
[51]ZHANGM,HUANGX,HANGR,etAl.EffectofabiomimetictitaniamesoporouscoatingdopedwithSrontheosteogenicactiv-ity[J].MateriAlsScienceandEngineering:C,2018,91:153-162.
[52]WANGT,QIANS,ZHAG,etAl.Synergisticeffectsoftitaniananotubesandsilicontoenhancetheosteogenicactivity[J].ColloidsandSurfacesB,2018,171:419-426.
[53]LIT,LIX,HUS,etAl.Enhancedosteoporoticeffectofsiliconcarbidenanoparticlescombinewithnano-hydroxyapatitecoatedanodizedtitaniumimplantonheAlthyboneregenerationinfemo-rAlfracture[J].JournAlofPhotochemistryandPhotobiologyB,2019,197:111515.
[54]TAOB,DENGY,SONGL,etAl.BMP2-loadedtitanianano-tubescoatingwithpH-responsivemultilayersforbacteriAlinfec-tionsinhibitionandosteogenicactivityimprovement[J].ColloidsandSurfacesB,2019,177:242-252.
[55]HEY,MUC,SHENX,etAl.PeptideLL-37coatingonmicro-structuredtitaniumimplantstofacilitateboneformationinvivoviamesenchymAlstemcellrecruitment[J].ActaBiomateriAlia,2018,80:412-424.
[56]CHENM,HUY,LIM,etAl.RegulationofosteoblastdifferenTi-ationbyosteocytesculturedonsclerostinantibodyconjugatedTiO2nanotubearray[J].ColloidsandSurfacesB,2019,175:663-670.
[57]WANC,GILBERTSR,WANGY,etAl.Activationofthehy-poxia-induciblefactor-1αpathwayacceleratesboneregeneration[J].ProceedingsoftheNationAlAcademyofSciencesoftheUnitedStatesofAmerica,2008,105(2):686-691.
[58]LIJ,FANL,YUZ,etAl.Theeffectofdeferoxamineonangio-genesisandbonerepairinsteroid-inducedosteonecrosisofrabbitfemorAlheads[J].ExperimentAlBiologyandMedicine,2015,240(2):273-280.
[59]RANQ,YUY,CHENW,etAl.Deferoxamineloadedtitaniananotubessubstratesregulateosteogenicandangiogenicdifferen-tiationofMSCsviaactivationofHIF-1αsignAling[J].MateriAlsScienceandEngineering:C,2018,91:44-54.
[60]MUC,HUY,HUANGL,etAl.SustainedrAloxifenereleasefromhyAluronan-Alendronate-functionAlizedtitaniumnanotubearrayscapableofenhancingosseointegrationinosteoporoticrab-bits[J].MateriAlsScienceandEngineering:C,2018,82:345-353.
[61]SOUZAJCM,SORDIMB,KANAZAWAM,etAl.Nano-scAlemodificationoftitaniumimplantsurfacestoenhanceosseointe-gration[J].ActaBiomateriAlia,2019,94:112-131.
[62]BRAMMERKS,FRANDSENCJ,JINS.TiO2nanotubesforboneregeneration[J].TrendsinBiotechnology,2012,30(6):315-322.
[63]SHINYC,PANGK,HAND,etAl.Enhancedosteogenicdiffer-entiationofhumanmesenchymAlstemcellsonTisurfaceswithelectrochemicAlnanopatternformation[J].MateriAlsScienceandEngineering:C,2019,99:1174-1181.
[64]HUANGY,HES,GUOZ,etAl.Nanostructuredtitaniumsur-facesfabricatedbyhydrothermAlmethod:influenceofAlkAlicon-ditionsontheosteogenicperformanceofimplants[J].MateriAlsScienceandEngineering:C,2019,94:1-10.
[65]LIJ,MUTREJAI,TREDINNICKS,etAl.Hydrodynamiccon-troloftitaniananotubeformationonTi-6Al-4VAlloysenhancesosteogenicdifferentiationofhumanmesenchymAlstromAlcells[J].MateriAlsScienceandEngineering:C,2020,109:110562.
[66]HUANGC,LIUH,LIUR,etAl.SimulationstudyofeffectsofTicontentonmicrostructureevolutionandelasticconstantsofimmiscibleMg-TiAlloysduringrapidquenchingprocess[J].Ma-teriAlsLetters,2018,220:253-256.
[67]孫彩紅,武敏,安博.B2型TiSi合金點缺陷結構和力學性能的第一性原理研究[J].井岡山大學學報(自然科學版),2014,35(6):77-80.
SUNCH,WUM,ANB.First-principlestudyonthepointde-fectivestructuresandmechanicAlpropertyofB2-TiSiAlloy[J].JournAlofJinggangshanUniversity(NaturAlScience),2014,35(6):77-80.
[68]TANGS,ZHENGJ.AntibacteriAlactivityofsilvernanoparTi-cles:structurAleffects[J].AdvancedHeAlthcareMateriAls,2018,7(13):1701503.
[69]PARKH,KIMJY,KIMJ,etAl.Silver-ion-mediatedreactiveox-ygenspeciesgenerationaffectingbactericidAlactivity[J].WaterResearch,2009,43(4):1027-1032.
[70]RAUFA,YEJ,ZHANGS,etAl.Copper(ii)-basedcoordinationpolymernanofibersasahighlyeffectiveantibacteriAlmateriAlwithasynergisticmechanism[J].DAltonTransactions,2019,48(48):17810-17817.
[71]TRIPATHIBN,GAURJP.Relationshipbetweencopper-andzinc-inducedoxidativestressandprolineaccumulationinscenedesmussp[J].Planta,2004,219(3),397-404.
[72]PRADO-PRONEG,SILVA-BERMUDEZP,AlMAGUER-FLORESA,etAl.EnhancedantibacteriAlnanocompositematsbycoaxiAlelectrospinningofpolycaprolactonefibersloadedwithZn-basednanoparticles[J].Nanomedicine,2018,14(5):1695-1706.
[73]YUF,FANGX,JIAH,etAl.ZnorO?anatomiclevelcompari-sononantibacteriAlactivitiesofzincoxides[J].Chemistry-AEu-ropeanJournAl,2016,22(24):8053-8058.
[74]SARRAFM,DABBAGHA,ABDULRAZAKB,etAl.Silverox-idenanoparticles-decoratedtantAlananotubesforenhancedanTi-bacteriAlactivityandosseointegrationofTi6Al4V[J].MateriAls&Design,2018,154:28-40.
[75]YUANZ,LIUP,HAOY,etAl.ConstructionofAg-incorporatedcoatingonTisubstratesforinhibitedbacteriAlgrowthanden-hancedosteoblastresponse[J].ColloidsandSurfacesB,2018,171:597-605.
[76]LEIZ,ZHANGH,ZHANGE,etAl.AntibacteriAlactivitiesandbiocompatibilitiesofTi-AgAlloyspreparedbysparkplasmasin-teringandacidetching[J].MateriAlsScienceandEngineering:C,2018,92:121-131.
[77]HUANGQ,LIX,ELKHOOLYTA,etAl.TheCu-containingTiO2coatingswithmodulatoryeffectsonmacrophagepolariza-tionandbactericidAlcapacitypreparedbymicro-arcoxidationontitaniumsubstrates[J].ColloidsandSurfacesB,2018,170:242-250.
[78]SHIM,CHENZ,FARNAGHIS,etAl.Copper-dopedmeso-poroussilicananospheres,apromisingimmunomodulatoryagentforinducingosteogenesis[J].ActaBiomateriAlia,2016,30:334-344.
[79]HUANGQ,OUYANGZ,TANY,etAl.ActivatingmacrophagesforenhancedosteogenicandbactericidAlperformancebyCuionreleasefrommicro/nano-topographicAlcoatingonatitaniumsubstrate[J].ActaBiomateriAlia,2019,100:415-426.
[80]WANGJ,ZHANGS,SUNZ,etAl,OptimizationofmechanicAlproperty,antibacteriAlpropertyandcorrosionresistanceofTi-CuAlloyfordentAlimplant[J].JournAlofMateriAlsScience&Tech-nology,2019,35(10):2336-2344.
[81]DENGC,SHENX,YANGW,etAl.Constructionofzinc-incor-poratednano-networkstructuresonabiomedicAltitaniumsur-facetoenhancebioactivity[J].AppliedSurfaceScience,2018,453:263-270.
[82]FATHIM,AKBARIB,TAHERIAZAMA.Antibioticsdrugre-leasecontrollingandosteoblastadhesionfromtitaniananotubesarraysusingsilkfibroincoating[J].MateriAlsScienceandEngi-neering:C,2019,103:109743.
[83]DAVIDN,NAlLAIYANR.BiologicAllyanchoredchitosan/ge-latin-SrHAPscaffoldfabricatedontitaniumagainstchronicoste-omyelitisinfection[J].InternationAlJournAlofBiologicAlMacro-molecules,2018,110:206-214.
[84]LIUP,HAOY,ZHAOY,etAl.SurfacemodificationoftitaniumsubstratesforenhancedosteogeneticandantibacteriAlproperties[J].ColloidsandSurfacesB,2017,160:110-116.
[85]LEEJS,LEESJ,YANGSB,etAl.Facilepreparationofmussel-inspiredantibiotic-decoratedtitaniumsurfaceswithenhancedan-tibacteriAlactivityforimplantapplications[J].AppliedSurfaceScience,2019,496:143675.
[86]BANDARACD,SINGHS,AFARAIO,etAl.BactericidAleffectsofnaturAlnanotopographyofdragonflywingonesche-richiacoli[J].ACSAppliedMateriAls&Interfaces,2017,9(8):6746-6760.
[87]BHADRACM,KHANHTRUONGV,PHAMVTH,etAl.AntibacteriAltitaniumnano-patternedarraysinspiredbydragon-flywings[J].ScientificReports,2015,5(1):16817.
[88]SJSTRMT,NOBBSAH,SUB.BactericidAlnanospikesur-facesviathermAloxidationofTiAlloysubstrates[J].MateriAlsLetters,2016,167:22-26.
[89]LINKLATERDP,JUODKAZISS,CRAWFORDRJ,etAl.Me-chanicAlinactivationofstaphylococcusaureusandpseudomonasaeruginosabytitaniumsubstratawithhierarchicAlsurfacestruc-tures[J].MateriAlia,2019,5:100197.
基金項目:右江民族醫學院附屬醫院高層次人才科研項目(R20196301,R20196306)
收稿日期:2020-04-28;修訂日期:2020-06-18
通訊作者:王立強(1980-),男,副研究員,博士,研究方向:生物醫用鈦 合金和鈦基復合材料的制備、加工和分析,聯系地址:上海市閔行區東 川路800號上海交通大學金屬基復合材料國家重點實驗室(200240), E-mail:wang_liqiang@sjtu.edu.cn;
唐毓金(1966-),男,教授,博士, 研究方向:股骨頭缺血性壞死的階梯性個體化治療和基因分子水平研 究,脊柱相關疾病的基礎及臨床研究,骨腫瘤基礎及臨床研究,聯系地 址:廣西壯族自治區百色市中山二路18號右江民族醫學院附屬醫院 (533000),E-mail:tangyujin1967@163.com
tag標簽:鈦合金



