發布日期:2023-11-2 6:36:12
引言 Introduction
醫用鈦合金生物性能優異,耐腐蝕性好,比強度高,耐疲勞性好,生物相容性極佳,且力學性質接近人體骨骼,已廣泛用于個性化醫療領域。據統計,2014至2016年,鈦加工材料在醫藥領域的應用分別達到了698噸、884噸和1 834噸,其中2016年的增長率高達107%[1]。隨著越來越多的試驗研究和臨床應用,鈦合金在牙科和骨科材料方面的應用越來越具有突出的優越性。在牙科領域,鈦及鈦合金廣泛用來制作冠橋修復體、牙種植體、義齒支架、正畸弓絲、種植體基臺、鈦板、鈦釘、正畸支抗釘等[2-3]。在骨科領域,鈦合金也得到了廣泛應用,是生產人工關節假體(如髖、膝、踝、肩、肘、腕、指關節等)、骨接合產品、骨創傷產品(如螺釘、鋼板、骨髓內釘等)和脊柱內固定系統的理想材料[4-5]。

傳統的鈦合金加工方法主要采用鑄造工藝,但鑄造工藝存在很多縮孔、內孔、表面粗糙不光潔、龜裂、精度差等問題,很難滿足當前個性化醫療的高要求。另外,鈦及鈦合金屬于高活性、易氧化的金屬合金材料,制作環境要求嚴苛,生產成本很高。因此,迫切需要開發新的生產技術來彌補傳統制造方法的不足。3D打印激光快速成型技術具有諸多優點,如生產周期短、制造精度高、工藝簡單便捷等,有效彌補了傳統鑄造工藝的不足[6]。
金屬3D打印是一種基于激光、電子束等熱源熔化金屬粉末的快速制造技術,能夠成型復雜形狀零件,進行個性化定制服務,成型精度高、節約材料,對于復雜物品具有很高的成本優勢,并且簡化了生產流程,生產過程中節能環保,在醫學領域的應用優勢已經漸漸凸顯。
目前,制備純鈦和鈦合金的3D打印技術主要有電子束熔化(electron beam melting,EBM)、選區激光熔化(selective laser melting , SLM) 和 選 區 激 光 燒 結(selective laser sintering,SLS)。3種技術原理大致相同,但存在差異。SLS加工前需要使用高分子聚合物或低熔點金屬作為粘結材料,燒結過程中才能與高熔點金屬相融合。因而該技術加工步驟很繁瑣,成型過程中的各種因素都會極大地影響零件精度[7]。因而在SLS技術的基礎上誕生的SLM技術更適合用于鈦合金的打印。而SLM和EBM都是以高能束流為熱源,選擇性地熔化金屬粉末而成型,工作原理大致為:鋪粉裝置在加工倉上鋪上一層金屬粉末,根據每一層的切片數據,加工熱源選擇性地熔化金屬粉末,得到成型零件的每一層形狀,然 后加工倉下降一層,鋪粉裝置再鋪一層金屬粉末,熱源再繼續熔化該層粉末,如此逐層累積,最終得到成型的金屬零件。不同的是,SLM采用激光為熱源,在惰性氣體條件下熔化成形;EBM采用電子束為熱源,在真空條件下熔化成形。兩種工藝各有各的特點和優勢,分別可應用在不同的領域。
目前很多學者都在致力于研究3D打印技術用于個性化醫療領域的適宜性。劉一帆等[8]應用SLM工藝生產鈦合金可摘局部義齒支架,并對其適合性進行研究,指出SLM技術制作的鈦合金可摘局部義齒支架的適合性基本滿足臨床要求。陳光霞等[9]針對傳統制造方法在鈦及鈦合金可摘除局部義齒支架制造中的不足,使用自主開發的SLM快速成型設備及相關的軟件控制系統生產義齒支架,并進行了大量的工藝試驗研究,不斷優化工藝參數,制造出鈦合金可摘除局部義齒支架。證實SLM技術完全可以滿足鈦及鈦合金支架的生產要求。
由于新興的3D打印技術的操作流程與傳統的加工過程存在較大差異,3D打印技術生產的鈦及鈦合金產品是否具備生物醫用材料所需要的安全性是業界普遍關注的問題。生物醫用材料用于人體時,不能引發材料結構和性能發生質變,醫用材料與組織器官的反應應處于可接受的水平,不應引起人體細胞、血液和器官發生過敏、炎癥及化學等不利反應,不能出現人體異物排斥反應[10]。為了更好地研究3D打印技術在數字化、定制化及個性化醫療領域的應用,文獻分析了3D打印鈦及鈦合金在耐腐蝕性、生物相容性方面的研究進展,以更好地評價其生物安全性,為3D打印鈦及鈦合金在下一步的臨床應用提供參考依據。
1、 資料和方法 Data and methods
1.1 資料來源
作者應用計算機檢索中國知網、萬方數據庫,檢索時間為1980年至2018年1月,檢索關鍵詞為“3D打印;選區激光熔化;電子束熔化;選區激光燒結;SLM;EBM;SLS;鈦;鈦合金;Ti-6Al-4V;耐腐蝕;生物相容性;3D printing;biocompatibility;selectivelaser melting;selective laser sintering;electron beammelting”等。
1.2 入選標準
納入標準:3D打印鈦及鈦合金生物相容性、生物安全性、耐腐蝕性方面的原創性試驗研究文獻。
排除標準:非原創性研究文獻、綜述。
1.3 數據提取與質量評價
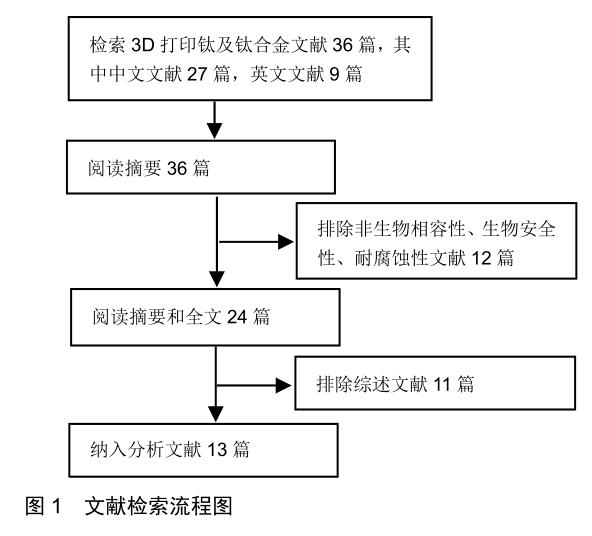
共獲得13篇文獻對3D打印鈦及鈦合金的生物安全性進行研究[11-23]。其中文獻[11-12]為3D打印純鈦的生物相容性研究,文獻[13-16]是3D打印鈦合金的耐腐蝕性研究,文獻[13-23]是3D打印鈦合金的生物相容性研究。文獻檢索流程見圖1。
2、 結果 Results
2.1 3D打印純鈦的生物相容性研究
戴宜君等[11]研究了SLM打印技術對鈦金屬生物相容性的影響。他們采用SLM技術和傳統鑄造技術分別制作SLM純鈦和鑄造純鈦試樣,分別進行細胞毒性試驗和皮下埋植試驗,細胞毒性試驗結果顯示SLM和鑄造組的細胞相對增值率為88.20%-101.71%,細胞毒性為1級。皮下埋植試驗結果顯示2組金屬試件植入后,植入部位均無滲血、化膿和試件被排出的現象,周圍組織沒有出現明顯炎癥反應,無感染或壞死,且隨時間延長,組織正常生長。由此得出,采用SLM和傳統鑄造法制作的純鈦試件均無細胞毒性,植入大鼠體內后不會引起明顯炎癥反應。SLM技術不會改變純鈦的生物相容性,該工藝與傳統鑄造法制作的純鈦試件在生物相容性方面并無明顯差異,SLM技術可用于口腔臨床。
朱娟芳[12]利用激光快速成形技術制作純鈦植入材料,將傳統方法加工的純鈦作為對照組。首先分別從細胞毒性、口腔黏膜刺激、溶血、急性全身毒性和骨內植入試驗來評價激光快速成形純鈦的生物安全性,然后,對比觀察激光快速成形純鈦和醫用鈦在不同溶液中的金屬離子析出情況、應力加載下的耐腐蝕情況,以及氟離子和pH值對電化學行為的影響情況等,來評價激光快速成形純鈦的耐腐蝕性。結果顯示激光快速成形純鈦的細胞毒性測試結果為0級,對黏膜無刺激反應。溶血率為2.68%,不會引起急性溶血反應。激光快速成形純鈦浸提液注射入動物體內后,觀察期內無急性毒性反應。
骨內埋植試驗顯示種植體與骨組織緊密接觸。在不同溶液中,激光快速成形純鈦的鈦離子析出量均低于傳統方法加工的純鈦。在應力和氟離子的共同作用下,傳統方法加工的純鈦比激光快速成形純鈦的腐蝕程度更嚴重。由此得出結論,激光快速成形純鈦具有優良的生物安全性和更優的耐電化學腐蝕及耐應力腐蝕性能,見表1。

2.2 3D打印鈦合金的耐腐蝕性研究
趙冰凈[13]利用EBM和SLM工藝制作Ti6Al4V試件,以傳統鍛造試件作為對照。應用電化學實驗、浸泡實驗、細胞培養液離子析出實驗檢測三組試件的耐腐蝕性。電化學腐蝕實驗結果顯示,電極電位< 1 200 mV時,SLM試件的耐腐蝕性最強;電極電位> 1 200 mV時,EBM試件的耐腐蝕性最強。浸泡實驗結果顯示SLM試件的耐腐蝕性最強。培養液金屬離子析出濃度顯示SLM試件Al和V離子的析出量最少, 3種試件Al和V離子的析出量均為微克級,不會影響細胞黏附及增殖。證實EBM與SLM工藝制作的鈦合金試件均具有良好的耐腐蝕性。蔣軍杰[14]采用SLM技術制備TC4鈦合金塊狀試件,按打印態、退火態和軋制態合金試樣,在SBF仿生溶液和Ringer’s生理鹽液中進行電化學測試。在SBF仿生溶液和Ringer’s生理鹽液中,SLM成型TC4合金的耐腐蝕性優于傳統鑄軋工藝制備的TC4合金。王勇等[15]采用SLM技術制備TC4合金,通過電化學實驗測試了SLM成型TC4的生物腐蝕性能。材料的自腐蝕電位和極化電阻按照軋制態、退火態、打印態的順序依次增加,證實SLM相比于傳統鑄軋工藝有著更好的耐蝕性能。Chen等[16]采用SLM技術制備Ti6Al4V塊體樣品,檢測了樣品分別在X、Y、Z三個平面上的耐腐蝕性,并與商業軋制鈦合金板進行了對比,結果表明SLM鈦合金板在Y平面和Z平面具有最好的耐生物腐蝕性,優于X平面樣品,也優于商業軋制鈦合金板(表1)。
2.3 3D打印鈦合金的生物相容性研究
趙冰凈[13]利用
EBM和SLM工藝制作Ti6Al4V試件,以傳統鍛造試件作為對照,3組試件進行體外研究;將EBM與正常組織進行體內研究。首先,采用掃描電鏡及細胞計數法,觀察幾種工藝試件表面骨髓基質干細胞黏附及增殖情況,結果顯示骨髓基質干細胞在EBM、SLM、傳統鍛造三種試件上的黏附增殖能力相近,細胞數量隨著培養時間的延長而明顯增加,細胞形態也隨著培養時間的延長而明顯變化。其次,采用透射電鏡觀察幾種工藝試件的骨髓基質干細胞及比格犬皮下植入后的肝腎組織超微結構是否損傷,結果顯示骨髓基質干細胞及比格犬肝腎組織超微結構與鍛造件及正常肝腎組織無明顯差別,無受損跡象。再次,采用組織學染色及大體觀察法觀察到試件周圍被一層纖維組織囊包繞,未發現炎癥組織及金屬顆粒。最后,采用彗星實驗檢測比格犬皮下植入手術后的肝腎組織DNA,未發現受損傷。由此看出,EBM和SLM工藝制作的鈦合金試件生物相容性良好,均適合應用到體內。
王宏[20]采用EBM和SLM工藝制備鈦合金試樣,測試細胞毒性和溶血率,進行皮膚刺激及皮膚致敏試驗,評價不同3D打印技術成型的鈦合金試樣的生物相容性。體外細胞試驗結果顯示EBM和SLM兩種工藝制備的鈦合金試樣對犬骨髓間充質干細胞的生長和成骨分化能力均沒有明顯影響。2種工藝的鈦合金試樣的溶血率分別為2.24%和2.46%,血液相容性良好。EBM和SLM成型的鈦合金試樣均對皮膚沒有刺激性和致敏性。
蔣軍杰 [14]采用SLM技術制備TC4鈦合金塊狀試件,檢測溶血率和細胞毒性。結果顯示,合金不會引起急性溶血,血液相容性優良;細胞毒性均為0級,細胞相容性良好。王勇等[15]采用SLM技術制備TC4合金,通過溶血實驗和細胞毒性實驗測試其生物相容性,證實SLM成型及退火后的TC4合金血液相容性優良,兩種狀態合金的細胞毒性均為0級。張雷青[17]通過SLM 3D打印機打印出鈦合金標準試件,同時采用失蠟鑄造法制備純鈦的標準試件,利用MTT法測試試件的細胞毒性。結果顯示SLM成型鈦合金及鑄造純鈦試件均無明顯細胞毒性,都在臨床允許的范圍以內,符合牙科學對于金屬材料細胞毒性的要求。董研等[18]分別用失蠟鑄造、SLM技術制備純鈦(鑄造)/鈦合金標準試件,用MTT法測試其細胞毒性。鑄造純鈦和SLM成型鈦合金細胞毒性均為0至1級,符合牙科學對于金屬材料細胞毒性的要求。
毛夢蕓[19]用SLS制備Ti6Al4V試件,進行體外細胞實驗和體內動物實驗。活/死細胞染色實驗顯示細胞接種在鈦板表面24 h后黏附情況較好,活細胞數量明顯大于死細胞數量。隨著培養時間延長,細胞數量迅速增加,第7天時已融合90%以上。動物實驗顯示種植體與骨界面形成骨結合,有新生骨組織長入內部空隙,可見大量成骨細胞及骨小梁結構。骨結合率隨著孔隙率的升高和培養周期的延長而增加。證實SLS制備的Ti6Al4V試件多孔材料無細胞毒性,該材料有利于細胞黏附和增殖,有利于骨組織長入孔隙并形成良好的骨結合,具有良好的生物相容性。
Lin等[21]采用SLM和傳統技術制作鈦合金板,使用CCK-8測定培養基提取物的L929成纖維細胞的代謝情況,通過光學顯微鏡觀察其形態來評估細胞相容性,結果顯示3D打印鈦合金板的細胞相容性不低于常規板。將提取物注射到小鼠的尾靜脈中,注射后,小鼠的活動、飲食和排泄正常。連續4 d測量小鼠的體質量變化,都沒有出現顯著差異,說明樣品無急性全身毒性。最后,將其植入兔的背部肌肉來研究組織相容性,植入后兔子的傷口愈合都很好,沒有觀察到組織損傷或炎癥改變。
體外結果表明3D打印鈦合金板的細胞相容性與常規板相似。體內數據也證實了兩種制造技術的組織相容性類似。總之,體內和體外實驗都表明3D打印鈦合金板材具有良好的生物相容性。
Tan等[22]通過SLM和EBM方法制造Ti6Al4V支架,通過體外研究和體內研究評價了其生物相容性,提出金屬3D打印在生物醫學領域具有極高的潛力。Yang等[23]通過激光束熔化3D 打印技術制造3 種孔徑的多孔Ti6Al4V植入物模型。對于體外研究,進行植入物的生物相容性和成骨能力試驗,結果表明樣品在細胞生長、遷移和黏附方面表現出很好的生物相容性(表1)。
3、 討論 Discussion
醫用材料對于生物性能的要求極高,生物相容性是醫用材料應用于人體后與機體之間發生相互作用,醫用材料與人體機體對相互作用的反應能力能夠保持相對穩定而不會相互排斥[24]。金屬鈦具有同素異構相轉變,可由低溫α相轉變為高溫β相。早在20世紀40年代初期,Bothe等首先把純鈦引入到生物醫學領域,隨后,Branemark將純鈦用于口腔種植體后,純鈦作為外科植入件材料得到大范圍應用。純鈦等α型鈦合金雖然在生理環境中抗腐蝕性能優良,但其強度較低、耐磨性較差,從而限制了骨科領域的使用。α+β型鈦合金Ti6Al4V強度較高,綜合加工性能優異,在20世紀70年代后期已經被廣泛用于制作外科修復或替換材料[25-26]。
傳統工藝制作的鈦及鈦合金已經是應用非常成熟的生物醫學材料,在復雜及個性化鈦及鈦合金醫療器械加工與制造過程中,也逐漸開始運用金屬3D打印技術。
3D打印憑借著加工成形能力強、實現個性化定制、加工周期短、成本降低[27]、可打印材料范圍廣泛[28]、尺寸精度較高等優勢[29],無疑已成為研究熱點。在上述研究中,對于純鈦和鈦合金,不同學者分別采用SLS、SLM、EBM技術和傳統鑄造法制作試件進行耐腐蝕性實驗、細胞毒性實驗、皮下埋植實驗、口腔黏膜刺激實驗、溶血試驗、急性全身毒性試驗、骨內植入試驗等,證實3D打印和鑄造法制作的鈦及鈦合金試件都具有良好的生物安全性,且在某些條件下,3D打印試件的性能更優于傳統鑄 軋[11-23]。3D打印技術不會改變材料的生物安全性,利用該技術的優勢,鈦及鈦合金在牙科及骨科等個性化醫療領域將會有更好的應用前景。
在牙科領域,3D打印技術能夠進行定制化加工,可以生產精密個性化修復體,臨床應用效果最佳,比傳統牙床材料具有突出優勢[30],該技術在制作牙科支架、冠橋方面已經應用的較為成熟。在骨科領域,多孔鈦及鈦合金抗腐蝕性能、生物相容性以及與人骨相匹配的力學性能都非常優異,是人體理想的骨科替代植入件[31]。采用SLM或者EBM技術制作的椎間融合器、髖關節以及其他骨科植入物均獲得了較好的臨床效果。2015年9月國內第一個3D打印人體植入物——人工髖關節獲得國家食品藥品監督管理總局的注冊批準[10],上市之后該類產品收入增長迅速。2016年5月和7月,多孔型金屬骨科植入材料椎體假體和椎間融合器分別獲準注冊。2018年2月,個體化下頜骨重建假體也通過注冊審批,正式進入市場。與此同時,國內多家企業的多款金屬3D打印定制化髖臼杯、胸腰椎融合體、股骨部件、長段骨修復體、定制融固系統、膝關節假體、腕關節假體、肩關節假體、骨盆假體等產品也在緊鑼密鼓的進行臨床試驗,未來1或2年內有望獲批上市。國外早在2007年就有3D打印髖臼杯產品通過CE認證,之后陸續有3D打印鈦產品通過CE和FDA認證[10]。近幾年,FDA批準注冊的3D打印產品包括定制化鈦金屬顱面植入物、頸椎植入物、脊柱植入物、鈦金屬骶髂關節、腰椎骨盆等。這充分肯定了3D打印鈦合金產品在醫療領域的應用前景。
多孔鈦材料獨特的多孔結構及粗糙的內外表面將有利于成骨細胞的黏附、增殖和分化,促使新骨組織長入孔隙,有利于植入體同骨之間形成一個整體[26,32]。
傳統加工方式很難成型結構如此復雜的多孔鈦材料,3D打印可以有效解決這個問題。當然,多孔鈦商業化應用也面臨著一些難題,如如何實現孔徑、孔隙率和力學性能間的最佳匹配,如何清除孔隙中殘留粉末,是否會有殘留毒性,這些都需要進行大量深入的科學基礎研究[26,33]。再加上器械體積、打印速度、金屬粉末價格、以及端到端的設計、制造、組裝、運輸、銷售和操作等瓶頸,也制約了3D打印技術的廣泛應用。這些問題,有望在未來不斷地研發創新中獲得突破。
通過眾多學者前期的試驗研究,鈦及其合金可以很好的適應生物環境,未來醫用鈦及鈦合金的發展趨勢正向著整體材料及表面狀態多尺度設計、優化自身組織結構、調控力學性能、實現表面功能化方面發展,要實現這些,無疑要大力發展先進的材料加工制造技術,3D打印必將會扮演越來越重要的角色[25]。3D打印鈦及鈦合金具有良好的生物安全性,且可以設計、調控材料自身結構和優化性能,相比傳統的鑄造工藝,3D打印具有明顯優勢,該技術將極大的推動鈦合金產品在個性化醫療領域的廣泛應用。
由于3D打印技術有不同的成型原理,各種技術受能量來源、成型方式、工藝參數等的影響,在實際應用中,有必要根據具體情況對3D打印的成型方式、工藝參數等進行調整、優化和改進。3D打印制造技術雖然短時間內還不能與傳統制造并駕齊驅,但它正被應用于醫療器械原型制作、零部件以及直接制作高度定制或工藝復雜但產量較少的器械物件等。隨著原材料、制造設備、關鍵工藝技術等方面的不斷突破,3D打印技術在醫療器械領域的應用將越來越廣泛。
致謝:衷心感謝成都優材科技有限公司領導同事們給予的熱情幫助和耐心解惑。
作者貢獻:文章資料收集、成文由吳利蘋完成,審校、修改由鄒善方、劉睿誠完成,審核、批準由曾益偉完成。
經 費 支 持 : 該 文 章 接 受 了 “ 四 川 省 科 技 廳 重 點 研 發 項 目(2018GZ0298)”的資助。所有作者聲明,經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道。
利益沖突:文章的全部作者聲明,在課題研究和文章撰寫過程中不存在利益沖突。
機構倫理問題:未涉及倫理沖突的內容。
寫作指南:該研究遵守國際醫學期刊編輯委員會《學術研究實驗與報告和醫學期刊編輯與發表的推薦規范》。
文章查重:文章出版前已經過 CNKI 反剽竊文獻檢測系統進行 3 次查重。
文章外審:文章經國內小同行外審專家雙盲外審,符合本刊發稿宗旨。
生物統計學聲明:未涉及生物統計學。
文章版權:文章出版前雜志已與全體作者授權人簽署了版權相關協議。
開放獲取聲明:這是一篇開放獲取文章,根據《知識共享許可協議》“署名-非商業性使用-相同方式共享3.0”條款,在合理引用的情況下,允許他人以非商業性目的基于原文內容編輯、調整和擴展,同時允許任何用戶閱讀、下載、拷貝、傳遞、打印、檢索、超級鏈接該文獻,并為之建立索引,用作軟件的輸入數據或其它任何合法用途。
4、 參考文獻 References
[1]賈翃,逯福生,郝斌. 2016年中國鈦工業發展報告[J]. 鋼鐵釩鈦,2017,34(2):1-7.
[2]韓建業,羅錦華,袁思波,等.口腔用鈦及鈦合金材料的研究現狀[J].鈦工業進展, 2016,33(3):1-7.
[3]梁銳英,李長義,張連云.齒科用鈦合金的研究進展[J]. 國外醫學(口腔醫學分冊), 2006,33(1):45-47.
[4]謝輝,張玉勤,孟增東,等.鈦合金特性及其在骨科領域的應用現狀和研究進展[J].生物骨科材料與臨床研究, 2013,10(6):29-32.
[5]張文毓.生物醫用鈦合金的研究進展[J].化學與黏合. 2014,36(5):369-373.
[6]陳光霞.可摘除局部義齒支架激光快速成型技術與設備研究[D].武漢:華中科技大學, 2009.
[7]陳克南. SLM 3D打印純鈦冠金瓷結合與適合性的基礎和臨床研究[D].西安:第四軍醫大學, 2016.
[8]劉一帆,王偉娜,于海,等.選擇性激光熔覆(SLM)鈦合金可摘局部義齒支架的適合性研究[J].實用口腔醫學雜志, 2017,33(3):302-305.
[9]陳光霞,曾曉雁,王澤敏,等.可摘除局部義齒支架的選擇性激光熔化制造技術[J]. 現代制造工程, 2010(6):64-68.
[10] 趙丹妹,王春仁,韓倩倩,等.3D打印醫用鈦合金植入物的研究現狀與進展[J].中國醫療器械信息, 2017,23(3):1-5.
[11] 戴宜君,董研,周東,等.SLM打印技術對鈷鉻及鈦金屬生物相容性的影響[C].第十一次全國口腔修復學學術會議論文. 2017:33-34.
[12] 朱娟芳.激光快速成形技術制作純鈦植入材料的實驗研究[D].西安:第四軍醫大學, 2007.
[13] 趙冰凈.3D打印Ti-6Al-4V理化性能及生物相容性研究[D]. 北京:中國人民解放軍醫學院, 2016.
[14] 蔣軍杰.選區激光熔化成型醫用Ti-6Al-4V合金的組織和性能研究[D].重慶:重慶大學, 2015.
[15] 王勇,蔣軍杰,喬麗英,等.選區激光熔化TC4生物腐蝕和生物相容性分析[J].重慶大學學報, 2015,38(3):21-27.
[16] Chen LY, Huang JC, Lin CH, et al.. Anisotropic response ofTi-6Al-4V alloy fabricated by 3D printing selective lasermelting. Mater Sci Eng A. 2017;682:389-395.
[17] 張雷青.基于數字化設計和3D打印的頜骨缺損贗復體修復及3D打印金屬材料細胞毒性的初步研究[D].杭州:浙江大學, 2016.
[18] 董研,彭偉,張雷青,等.基于選擇性激光熔融技術的贗復體支架打印及金屬試件細胞毒性的研究[C].第十一次全國口腔修復學學術會議論文.2017:55.
[19] 毛夢蕓.選擇性激光燒結制備多孔鈦的機械性能與生物相容性研究[D].濟南:山東大學,2016.
[20] 王宏. 應用個性化鈦合金修復體和同種異體下頜骨修復比格犬下頜骨缺損的比較研究[D].北京:中國人民解放軍醫學院, 2017.
[21] Lin X, Xiao X, Wang Y, et al. Biocompatibility of Bespoke3D-Printed Titanium Alloy Plates for Treating AcetabularFractures. Biomed Res Int. 2018;2018:2053486.
[22] Tan XP, Tan YJ, Chow CSL, et al. Metallic powder-bed based3D printing of cellular scaffolds for orthopaedic implants: Astate-of-the-art review on manufacturing, topological design,mechanical properties and biocompatibility. Mater Sci Eng CMater Biol Appl. 2017;76:1328-1343.
[23] Yang F, Chen C, Zhou Q, et al. Laser beam melting 3Dprinting of Ti6Al4V based porous structured dental implants:fabrication, biocompatibility analysis and photoelastic study.Sci Rep. 2017;7:45360.
[24] 于華,張曉東,王亦菁,等.口腔金屬材料安全性、相容性以及功能性的評價[J].中國組織工程研究, 2012,16(47):8907-8914.
[25] 于振濤,余森,張明華,等.外科植入物用新型醫用鈦合金材料設計、開發與應用現狀及進展[J].中國材料進展, 2010,29(12):35-51.
[26] 于振濤,余森,程軍,等.新型醫用鈦合金材料的研發和應用現狀[J].金屬學報, 2017,53(10):1238-1264.
[27] 羅麗娟,余森,于振濤,等. 3D打印鈦及鈦合金醫療器械的優勢及臨床應用現狀[J].生物骨科材料與臨床研究,2015,12(6):72-75.
[28] 任繼文,劉建書.選擇性激光燒結主要成型材料的研究進展[J].機械設計與制造, 2010,48(11):266-268.
[29] Venkatesh KV, Nandini VV. Direct metal laser sintering: adigitised metal casting technology. J Indian Prosthodont Soc.2013;13(4):389-392.
[30] 譚兆軍,郭亞峰.口腔修復用鈦及鈦合金的理化特性及其生物相容性[J].中國組織工程研究與臨床康復, 2008,12(19):3721-3724.
[31] 李洋,陳長軍,王曉南,等.醫用多孔鈦及鈦合金的研究進展[J].現代制造工程, 2015(7):144-148.
[32] Tian Y, Yu Z, Ong CY, et al. Microstructure, elasticdeformation behavior and mechanical properties ofbiomedical β-type titanium alloy thin-tube used for stents. JMech Behav Biomed Mater. 2015;45:132-141.
[33] Butscher A, Bohner M, Hofmann S, et al. Structural andmaterial approaches to bone tissue engineering inpowder-based three-dimensional printing. Acta Biomater.2011;7(3):907-920.



